
科目: 来源: 题型:
235 92 |
239 94 |
查看答案和解析>>
科目: 来源: 题型:
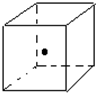
 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题:
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题:
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |

| 高温 |
查看答案和解析>>
科目: 来源: 题型:


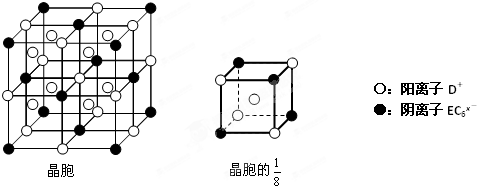
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com