
科目: 来源: 题型:阅读理解


查看答案和解析>>
科目: 来源: 题型:





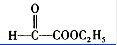
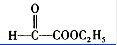
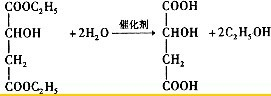

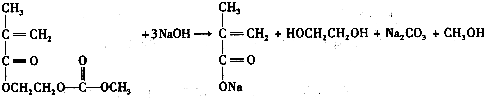
查看答案和解析>>
科目: 来源: 题型:
| 实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
| 验证氧化性 | ||
| 验证不稳定性 |
查看答案和解析>>
科目: 来源: 题型:
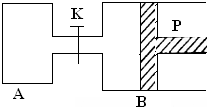 如图所示,P为一可自由滑动的活塞,关闭K,分别向容器A、B中均各充入2mol X、2mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达到平衡时,VB=0.6a L.
如图所示,P为一可自由滑动的活塞,关闭K,分别向容器A、B中均各充入2mol X、2mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达到平衡时,VB=0.6a L.查看答案和解析>>
科目: 来源: 题型:阅读理解
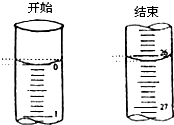 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠 溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目: 来源: 题型:

| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 | 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com