(2013?揭阳一模)酸性条件下,锡在水溶液中有Sn
2+、Sn
4+两种主要存在形式.SnSO
4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如图:
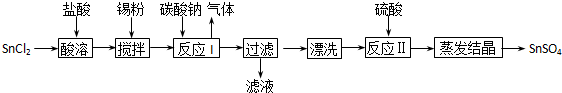
回答下列问题:
(1)SnCl
2用盐酸而不用水直接溶解的原因是
抑制Sn2+水解
抑制Sn2+水解
,加入锡粉的作用是
防止Sn2+被氧化
防止Sn2+被氧化
.
(2)反应I生成的沉淀为SnO,写出该反应的化学方程式:
SnCl2+Na2CO3=SnO+CO2↑+2NaCl
SnCl2+Na2CO3=SnO+CO2↑+2NaCl
.
(3)检验沉淀已经“洗涤”干净的操作是:
取少量最后一次洗涤液于试管中,滴入几滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已洗涤干净
取少量最后一次洗涤液于试管中,滴入几滴AgNO3溶液,若无白色沉淀生成,则说明沉淀已洗涤干净
.
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH.若溶液中c(Sn
2+)=1.0mol?L
-1,则室温下应控制溶液pH
小于1
小于1
.(已知:Ksp[Sn(OH)
2]=1.0×10
-26)
(5)酸性条件下,SnSO
4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:
Sn2++H2O2+2H+=Sn4++2H2O
Sn2++H2O2+2H+=Sn4++2H2O
.
(6)潮湿环境中,镀锡铜即使锡层破损也能防止形成铜绿,请结合有关的原理解释其原因:
潮湿环境中,Sn与Cu构成原电池,Sn作为负极,保护正极Cu不被氧化
潮湿环境中,Sn与Cu构成原电池,Sn作为负极,保护正极Cu不被氧化
.




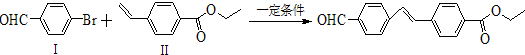
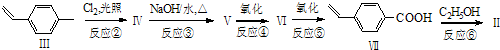


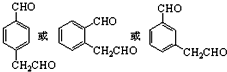



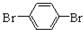 与化合物
与化合物 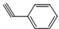 在一定条件下按物质的量之比1:2可发生类似反应①的反应,请写出其产物的结构简式
在一定条件下按物质的量之比1:2可发生类似反应①的反应,请写出其产物的结构简式