
科目: 来源: 题型:阅读理解
查看答案和解析>>
科目: 来源: 题型:阅读理解
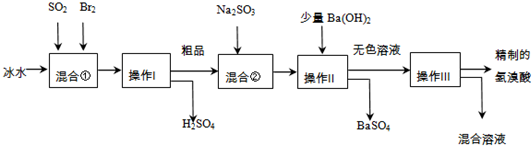
 (2013?闵行区二模)研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(2013?闵行区二模)研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 | △ |
查看答案和解析>>
科目: 来源: 题型:
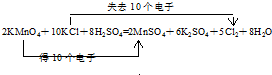

查看答案和解析>>
科目: 来源: 题型:
| △ |
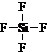
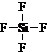
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
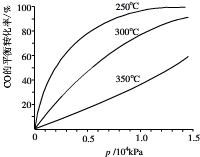
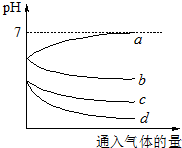 (2013?闵行区二模)向等体积等物质的量浓度的H2S和SO2的水溶液各两份中,分别通入不同的气体,一段时间后,如图表示通入的气体的量与溶液pH关系的曲线图,下列说法中正确的是( )
(2013?闵行区二模)向等体积等物质的量浓度的H2S和SO2的水溶液各两份中,分别通入不同的气体,一段时间后,如图表示通入的气体的量与溶液pH关系的曲线图,下列说法中正确的是( )查看答案和解析>>
科目: 来源: 题型:
 (2013?闵行区二模)用内置有螺旋状铜丝的胶头滴管小心吸取一滴管浓硝酸后迅速插入细口瓶中(如右图),滴管与瓶口接触处垫一小块滤纸使滴管与瓶口留少量空隙,依次观察到如下现象:①滴管内产生红棕色气体,液面下降;②滴管内液面上升,气体变成无色;③滴管内液面再次下降.下列说法中错误的是( )
(2013?闵行区二模)用内置有螺旋状铜丝的胶头滴管小心吸取一滴管浓硝酸后迅速插入细口瓶中(如右图),滴管与瓶口接触处垫一小块滤纸使滴管与瓶口留少量空隙,依次观察到如下现象:①滴管内产生红棕色气体,液面下降;②滴管内液面上升,气体变成无色;③滴管内液面再次下降.下列说法中错误的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com