
科目: 来源: 题型:
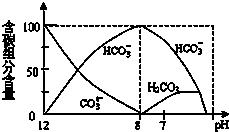 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.查看答案和解析>>
科目: 来源: 题型:
| 化学键 | 键能(kJ/mol) | 化学键 | 键能(kJ/mol) |
| N≡N | 942 | H-O | 460 |
| N-H | 391 | O=O | 499 |
| H-H | 437 |
查看答案和解析>>
科目: 来源: 题型:

| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 | Zn(OH)2 |
| 开始沉淀时的pH | 7.6 | 5.2 | 2.7 | 8.0 |
| 完全沉淀时的pH | 9.6 | 6.7 | 3.7 | 11.0 |
查看答案和解析>>
科目: 来源: 题型:
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
查看答案和解析>>
科目: 来源: 题型:
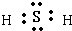
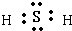
查看答案和解析>>
科目: 来源: 题型:
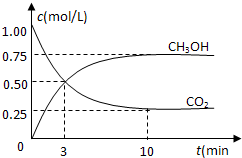 在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:查看答案和解析>>
科目: 来源: 题型:
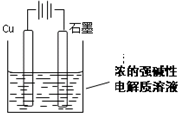 Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com