(2012?闸北区二模)合成氨的原料气之一氢气可由天然气(甲烷)与水蒸汽在一定条件下反应制得:
CH
4+H
2O (g)→CO+3H
2①; CO+H
2O (g)→CO
2+H
2②
CO和CO
2都可以合成甲醇:
CO+2H
2→CH
3OH ③; CO
2+3H
2→CH
3OH+H
2O ④
(1)1m
3CH
4与足量水蒸气反应,理论上最多可制得同温同压下的H
24
4
m
3;现有100mol CH
4,与水蒸汽充分反应产生的CO和CO
2的体积比为3:1,则此时产生的气体(不含CH
4)中H
2有
325
325
mol;若以150L CH
4和H
2O的混合气体为原料,制备CO、CO
2和H
2混合气体,当CH
4和H
2O均完全反应后,在相同条件下反应后气体的体积为
250L<v<300L
250L<v<300L
(写范围).
(2)若反应①的气体产物共为V
1L,则合成甲醇时H
2过量0.25V
1L;反应②的气体产物共为V
2L,则合成甲醇时H
2不足(H
2少V
2L).为了充分利用原料,可将两个反应的产物混合使用,则V
1与V
2最佳比例为
4:1
4:1
.
(3)若以CH
4、CO、H
2O混合气体为原料气在一定条件下充分反应,所得气体用以合成甲醇,为使原子利用率都达到100%,则CH
4、CO、H
2O的最佳配比为
1:2:1
1:2:1
.
(4)为了充分利用原料,合成氨厂也可同时生产甲酸和甲醇.有关反应式为:
2CH
4+O
2→2CH
3OH ⑤; CO
2+H
2→HCOOH ⑥;
由空气制得的液态氮和液态氧的物质的量之比为4:1,若充分利用液态氮以及CH
4与足量水蒸气反应产生的物质,每生产80mol NH
3(设水气足量),得到20mol HCOOH,试计算同时可得到CH
3OH的物质的量.

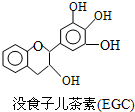 茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.“茶倍健”牙膏中就添加有某种茶多酚--没食子儿茶素(EGC),其结构如图所示.下列关于没食子儿茶素(EGC)的叙述中不正确的是( )
茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.“茶倍健”牙膏中就添加有某种茶多酚--没食子儿茶素(EGC),其结构如图所示.下列关于没食子儿茶素(EGC)的叙述中不正确的是( )