
科目: 来源: 题型:
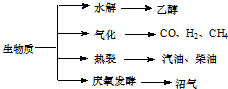
| 气化反应式 | lgK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
查看答案和解析>>
科目: 来源: 题型:
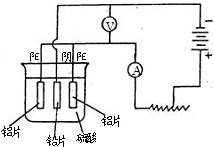 铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理.他们的实验步骤如下:
铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理.他们的实验步骤如下:
| ||
查看答案和解析>>
科目: 来源: 题型:
| 化学反应方程式(例子) | 能量转化形式 | ||||
①C+O2
|
|||||
②MgxMo3S4
|
|||||
| ③ |
由热能转化为化学能 |
查看答案和解析>>
科目: 来源: 题型:
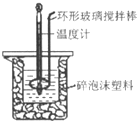 用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目: 来源: 题型:
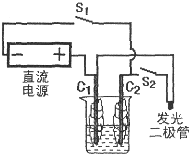 燃料电池是一种将化学反应产生的能量直接转换成电能的装置.某研究性学习小组在一次活动中,参照下图组装实验装置,以外面缠绕棉花的碳棒为电极,电解质溶液用0.5mol?L-1Na2SO4溶液,电源用3~6V直流电源,发光二极管起辉电压为1.7V,电流为0.6mA.
燃料电池是一种将化学反应产生的能量直接转换成电能的装置.某研究性学习小组在一次活动中,参照下图组装实验装置,以外面缠绕棉花的碳棒为电极,电解质溶液用0.5mol?L-1Na2SO4溶液,电源用3~6V直流电源,发光二极管起辉电压为1.7V,电流为0.6mA.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
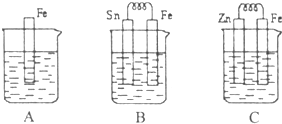 I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.查看答案和解析>>
科目: 来源: 题型:
 用铜片、锌片和200mL稀H2SO4等组成原电池(如图).若整个实验过程有6.5g锌溶解,此时H2SO4恰好全部用完.回答下列问题:
用铜片、锌片和200mL稀H2SO4等组成原电池(如图).若整个实验过程有6.5g锌溶解,此时H2SO4恰好全部用完.回答下列问题:查看答案和解析>>
科目: 来源: 题型:
 (1)以H2、O2和强碱溶液设计一个氢氧燃料电池,参与正极反应的物质是
(1)以H2、O2和强碱溶液设计一个氢氧燃料电池,参与正极反应的物质是查看答案和解析>>
科目: 来源: 题型:
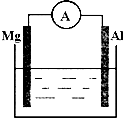 如图所示装置:
如图所示装置:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com