
科目: 来源: 题型:
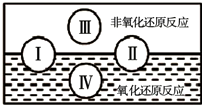
| 编号 | 物质 | 试剂名称或化学式 |
| ① | 除杂质:NaHCO3溶液(Na2CO3) | |
| ② | 除杂质:SiO2(CaCO3) | |
| ③ | 除杂质:FeCl2溶液(FeCl3) | |
| ④ | 鉴别:Na2CO3 Na2SiO3 Na2SO3溶液 | |
| ⑤ | 鉴别:(NH4)2SO4 NH4Cl Na2SO4溶液 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
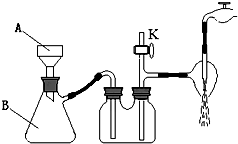 高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.
高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.| NaNO3 | KNO3 | NaCl | KCl | |
| 10°C | 80.5 | 20.9 | 35.7 | 31.0 |
| 100°C | 175 | 246 | 39.1 | 56.6 |
查看答案和解析>>
科目: 来源: 题型:
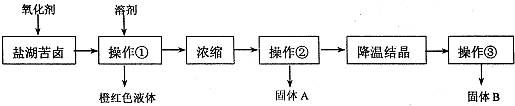
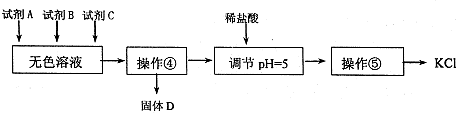
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
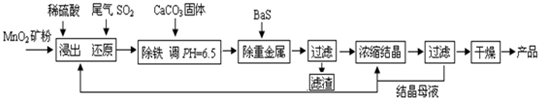
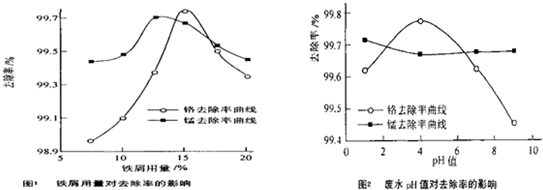
查看答案和解析>>
科目: 来源: 题型:
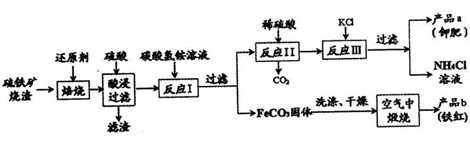
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com