
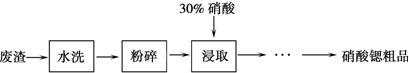
科目: 来源: 题型:
| 温度/℃物质 | 0 | 20 | 30 | 45 | 60 | 80 |
| Sr(NO3)2 | 28.2 | 40.7 | 47 | 47.2 | 48.3 | 49.2 |
| Ca(NO3)2?4H2O | 102 | 129 | 152 | 230 | 300 | 358 |
| O | 2- 3 |
| O | 2- 3 |
查看答案和解析>>
科目: 来源: 题型:
| A、加过量CaCO3除去乙酸后再蒸馏 | B、加过量CaO固体后,再蒸馏 | C、三者沸点不同,可直接分馏 | D、加CCl4萃取后,再分液 |
查看答案和解析>>
科目: 来源: 题型:
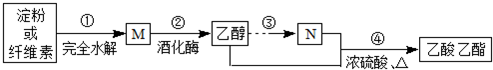
| A、M的分子式为C6H12O6 | B、N的结构简式为CH3COOH | C、④的反应类型属于取代反应 | D、淀粉与纤维素互为同分异构体 |
查看答案和解析>>
科目: 来源: 题型:
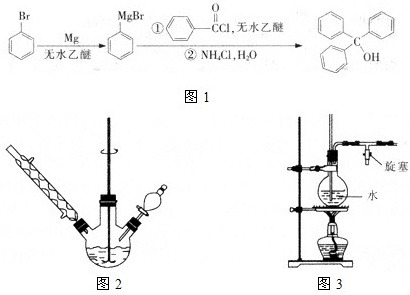
| 1 | 3 |
查看答案和解析>>
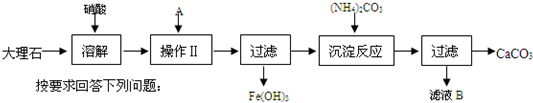
科目: 来源: 题型:
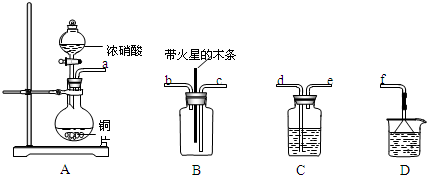
查看答案和解析>>
科目: 来源: 题型:
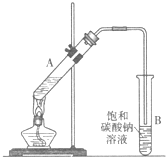 乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.
乙酸乙酯是重要的化工原料.实验室合成乙酸乙酯的装置如图所示.| 乙酸 | 乙醇 | 乙酸乙酯 | 乙醚 | |
| 沸点/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 极易溶于水 | 与乙醚混溶 | 微溶于水 |
| 浓硫酸 |
| ℃140 |
查看答案和解析>>
科目: 来源: 题型:
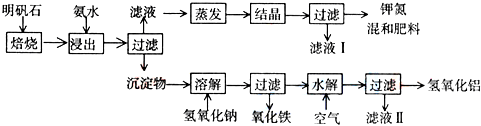
查看答案和解析>>
科目: 来源: 题型:
| ||
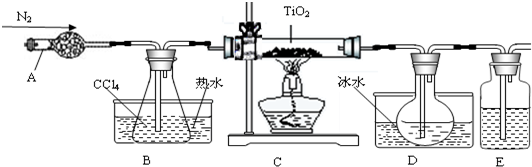
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
| ||
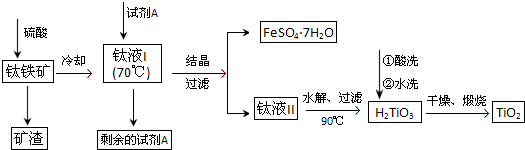
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com