
科目: 来源: 题型:
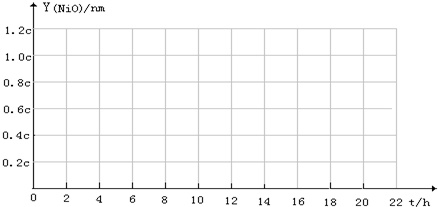
| 反应时间t (h) | 1 | 4 | 9 | 16 | 25 |
| MgO膜厚Y (nm) | 0.02a | 0.08a | 0.18a | 0.32a | 0.50a |
| ZnO 膜厚Y (nm) | 1.0×10-3b | 4.0×10-3b | 9.0×10-3b | 1.6×10-2b | 2.5×10-2b |
| NiO 膜厚Y (nm) | 0.3c | 0.6c | 0.9c | 1.2c | 1.5c |
查看答案和解析>>
科目: 来源: 题型:阅读理解
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 1 | 2 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 温度/ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
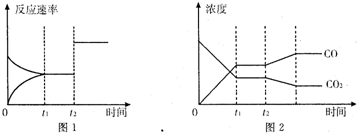
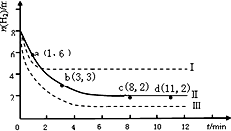
| 时间(min) | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.120 | 0.220 | 0.080 | 0.080 |
| 3 | 0.080 | 0.180 | 0.120 | 0.120 |
| 4 | 0.100 | 0.200 | 0.100 | C1 |
| 5 | 0.067 | 0.267 | 0.133 | C2 |
查看答案和解析>>
科目: 来源: 题型:
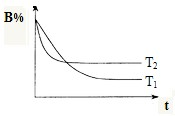 在t℃时,向容积为2L的密闭容器甲中加入1mol A气体、3mol B气体及少量固体催化剂,发生下列反应:A(g)+3B(g)?2C(g);△H<0,10min后各物质的浓度不再变化,测得气体C的体积分数为25%.请填空:
在t℃时,向容积为2L的密闭容器甲中加入1mol A气体、3mol B气体及少量固体催化剂,发生下列反应:A(g)+3B(g)?2C(g);△H<0,10min后各物质的浓度不再变化,测得气体C的体积分数为25%.请填空:查看答案和解析>>
科目: 来源: 题型:
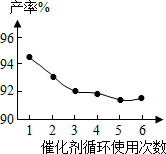
| 铌酸用量/mol | 0.01 | 0.02 | 0.03 | 0.05 | 0.1 | 0.15 | 0.2 | 0.6 |
| 产率% | 87.3 | 88.2 | 90.3 | 94.2 | 92.9 | 93.1 | 91.8 | 92.3 |
| 转化率% | 89.7 | 92.1 | 93.9 | 98.9 | 94.9 | 95.7 | 93.9 | 94.3 |
| 序号 | 醛 | 醇 | 转化率% | 产率% |
| 1 | 邻羟基苯甲醛 | 甲醇 | 94.3 | 89.6 |
| 2 | 对羟基苯甲醛 | 甲醇 | 93.6 | 88.7 |
| 3 | 邻氯苯甲醛 | 甲醇 | 93.1 | 87.3 |
| 4 | 间硝基苯甲醛 | 甲醇 | 54.2 | 34.1 |
| 5 | 邻硝基苯甲醛 | 甲醇 | 89.9 | 79.5 |
| 6 | 对硝基苯甲醛 | 甲醇 | 65.7 | 41.9 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
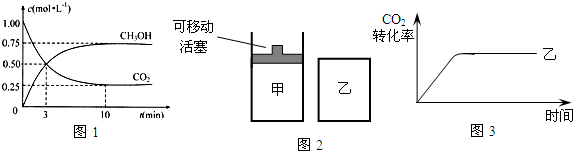
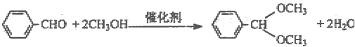
 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法: CH3OH(g)+H2O(g)+49kJ
CH3OH(g)+H2O(g)+49kJ查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com