
科目: 来源: 题型:
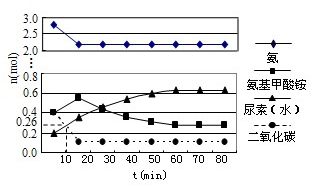
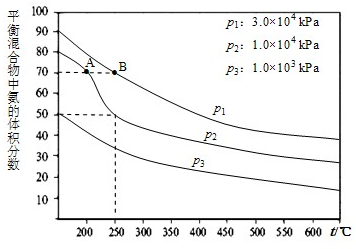 在工业合成尿素时常用NH3与CO2作原料进行生产.
在工业合成尿素时常用NH3与CO2作原料进行生产.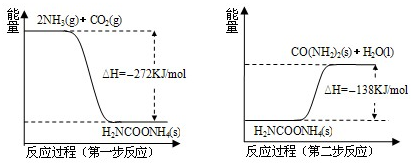
查看答案和解析>>
科目: 来源: 题型:
 将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)
将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)| 催化剂 |
查看答案和解析>>
科目: 来源: 题型:
 I.高炉炼铁中发生的基本反应之一是FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0.其平衡常数可表达为k=c(CO2)/c(CO),已知1100℃时,k=0.263.
I.高炉炼铁中发生的基本反应之一是FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0.其平衡常数可表达为k=c(CO2)/c(CO),已知1100℃时,k=0.263.查看答案和解析>>
科目: 来源: 题型:
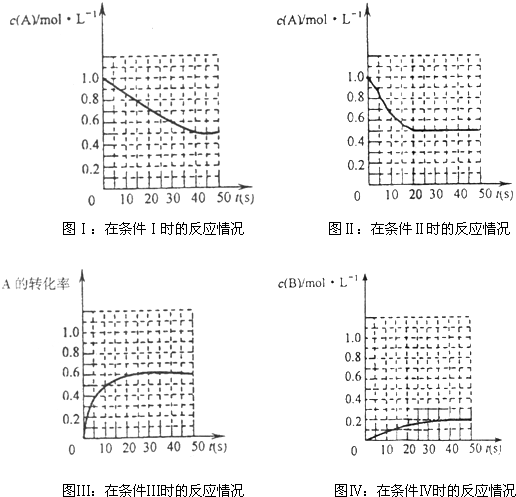
| A、条件Ⅰ、条件Ⅱ时的反应温度不同,压强相同 | B、条件Ⅰ时可能未使用催化剂,条件Ⅱ时可能使用了催化剂 | C、条件Ⅲ时的平衡混合物中,物质C的浓度等于0.6mol?L-1 | D、条件Ⅳ和条件Ⅱ相比较,条件Ⅳ时可能增大了反应体系的压强 |
查看答案和解析>>
科目: 来源: 题型:
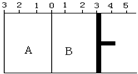
 将A与B的混合气体分别置于恒压容器甲和恒容容器乙中,发生如下反应:2A(g)+2B(g)?3C(g);△H<0.下列说法不正确的是( )
将A与B的混合气体分别置于恒压容器甲和恒容容器乙中,发生如下反应:2A(g)+2B(g)?3C(g);△H<0.下列说法不正确的是( )| A、在相同条件下两容器内的反应均达到化学平衡状态,升温时甲、乙两容器中反应速率均增大 | B、在相同条件下两容器内的反应均达到化学平衡状态,升温时甲乙两容器中的平衡均向逆方向移动 | C、在相同温度下,甲容器中加入2molA和2molB,乙容器中加入3molC,若甲容器经30s达到平衡状态,则乙容器达到平衡时所需要的时间也是30s | D、在相同的温度和压强下,用甲容器分别进行反应.第一次加入2molA和2molB;第二次加入2molA.2molB和3molC;第三次加入4molC.分别达到化学平衡状态时,C的物质的量百分含量分别为X、Y、Z.则X、Y、Z的大小关系是X=Y=Z |
查看答案和解析>>
科目: 来源: 题型:
| A、升高温度化学反应速率加快,是因为单位体积内活化分子百分数增加 | B、将SO2通入BaCl2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸 | C、鸡蛋清溶液中加入饱和CuSO4溶液析出沉淀,说明蛋白质发生了盐析 | D、滴有酚酞的Na2CO3溶液中滴加BaCl2溶液后红色变浅,说明BaCl2溶液有酸性 |
查看答案和解析>>
科目: 来源: 题型:
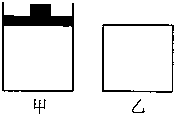
为了研究温度对苯催化加氢生成环己烷(C6H12)的影响,以检验新型镍催化剂的性能,采用恒压微型反应装置进行如下实验,在反应时间等其他条件相同时,定时取样分离出氢气后,分析成分如下:
| ||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源: 题型:阅读理解
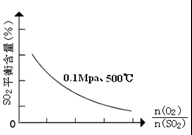 (1)在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
(1)在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:| 催化剂 |
| △ |
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
| n(O2) |
| n(SO2) |
| n(O2) |
| n(sO2) |
查看答案和解析>>
科目: 来源: 题型:
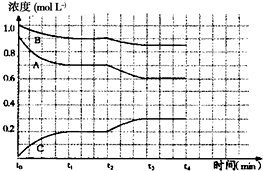 有如下化学反应:2A(g)+B(g)?2C(g),△H<0.
有如下化学反应:2A(g)+B(g)?2C(g),△H<0.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com