
科目: 来源: 题型:
| 时间/s n/mol |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目: 来源: 题型:
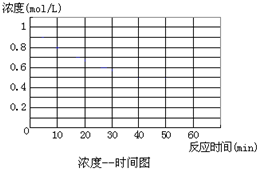 某化学反应2A(g)B (g)+D(g)在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示.
某化学反应2A(g)B (g)+D(g)在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示.实验序号 |
时间 浓度 温度/℃ |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| 4 | 760 | 1.0 |
查看答案和解析>>
科目: 来源: 题型:
| t/(K) | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目: 来源: 题型:
实验 序号 |
浓度 时间 温度 |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目: 来源: 题型:
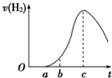 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 时间/物质的量 | n(A)(mol) | n(B)(mol) | n(C)(mol) | n(D)(mol) |
| 起始 | 0.9 | 1.4 | 0 | 0.2 |
| 第1min | 0.6 | 1.1 | 0.15 | |
| 第2min | 0.4 | 0.9 | 0.25 | |
| 第3min | 0.3 | 0.8 | 0.8 | |
| 第4min | 0.3 | 0.8 | 0.3 | 0.8 |
| 第5min | 0.35 | 0.85 | 0.275 | 0.75 |
查看答案和解析>>
科目: 来源: 题型:
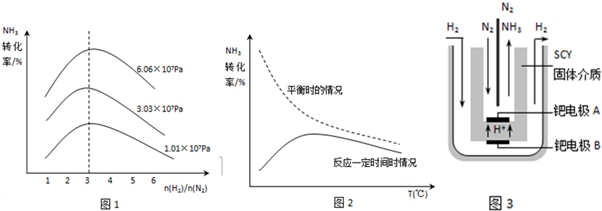
| 3 | 2 |
查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
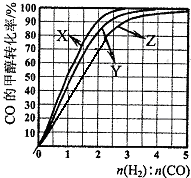
查看答案和解析>>
科目: 来源: 题型:
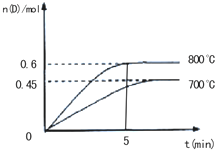 在容积为2L的密闭容器中,进行反应:A(g)+2B(g)C(g)+D(g)
在容积为2L的密闭容器中,进行反应:A(g)+2B(g)C(g)+D(g)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com