
科目: 来源: 题型:
| 电解质溶液 | 阴极析出物质 | |
| 实验1 | CuS04溶液 | 红色固体 |
| 实验2 | CuS04和NaCl的混合溶液 | 红色固体和少量白色固体 |
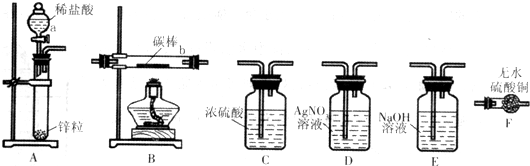
查看答案和解析>>
科目: 来源: 题型:阅读理解
查看答案和解析>>
科目: 来源: 题型:
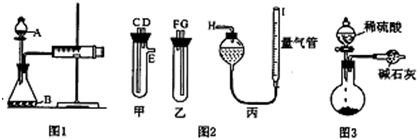
查看答案和解析>>
科目: 来源: 题型:阅读理解
| ||
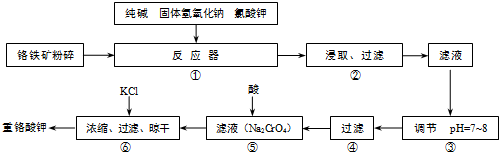
| 操作步骤 | 实验现象 | 结论 |
| ①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置. | 试管中仍有固体物质 | 固体为 |
| ②操作①后,过滤;在滤液中加入过量的 |
有红褐色沉淀产生 | 沉淀为Fe(OH)3 |
| ③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2. | 生成物为Al(OH)3 |
查看答案和解析>>
科目: 来源: 题型:
| ||
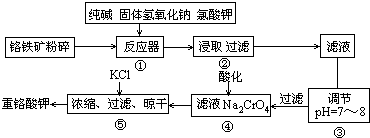
查看答案和解析>>
科目: 来源: 题型:阅读理解
| NaOH溶液 |
| 稀硫酸 |
查看答案和解析>>
科目: 来源: 题型:
| 装置编号 | 实验现象 | 反应的离子方程式 | SO2表现的化学性质 |
| 乙 | - | ||
| 丙 | 黄色溶液变为浅绿色 |
2- 3 |
2- 4 |
2- 3 |
2- 4 |
| 编号 | 实验操作 | 预期现象和结论 | ||
| 步骤① | 取少量待测液于试管A中,滴加2mol?L-1盐酸至溶液呈酸性,加入几滴 |
| ||
| 步骤② | ||||
| 步骤③ | 另取少量待测液于试管C中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色 | 证明待测液中含有Br- |
查看答案和解析>>
科目: 来源: 题型:

| 1 |
| 2 |
| 1 |
| 2 |
| ||
. |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 溶解度(S)/g | 溶度积(Ksp) | 摩尔质量(M)/g?mol-1 | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com