
科目: 来源: 题型:阅读理解
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.00 | 31.00 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
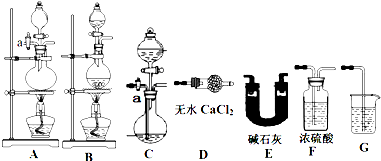
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| V[HCl(aq)]/mL | 11.95 | 12.50 | 12.05 |
查看答案和解析>>
科目: 来源: 题型:
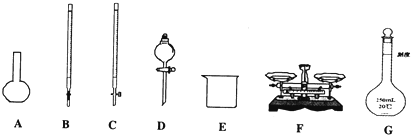
查看答案和解析>>
科目: 来源: 题型:
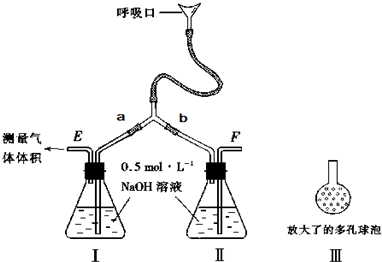
查看答案和解析>>
科目: 来源: 题型:
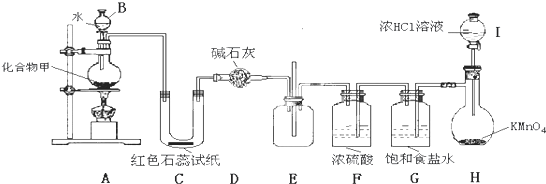
查看答案和解析>>
科目: 来源: 题型:
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量漂白粉溶于足量蒸馏水,充分搅拌,静置,过滤,得沉淀和滤液. | / |
| 步骤2:向沉淀加入适量2mol?L-1HCl溶液,将产生的气体通入 |
现象: 结论: |
| 步骤3:取滤液分装A、B两支试管.向A试管, |
现象:溶液先变红色,然后褪色. 结论: |
| 步骤4:向B试管, |
现象:产生白色沉淀. 结论: |
查看答案和解析>>
科目: 来源: 题型:阅读理解
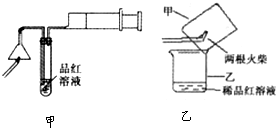
查看答案和解析>>
科目: 来源: 题型:阅读理解
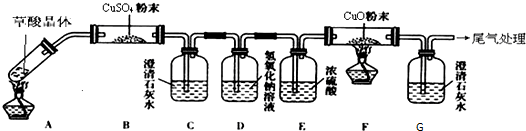
查看答案和解析>>
科目: 来源: 题型:
| ||
| △ |
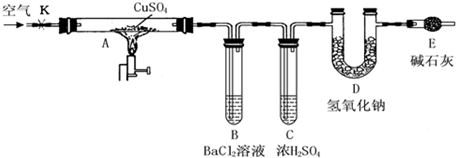
| △ |
查看答案和解析>>
科目: 来源: 题型:
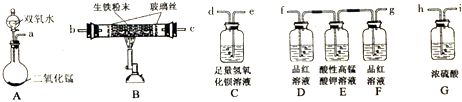
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com