
科目: 来源: 题型:
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 6.830 | 13.660 | 30.000 |
| 二氧化硫气体的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.800 | 1.600 | 3.200 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
查看答案和解析>>
科目: 来源: 题型:
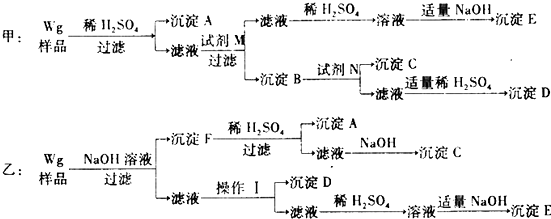
查看答案和解析>>
科目: 来源: 题型:阅读理解
查看答案和解析>>
科目: 来源: 题型:
 三聚氰胺因“毒奶粉”事件成为了社会焦点.某同学为了测定三聚氰胺的分子式,查阅资料得知:三聚氰胺的相对分子质量为126,在常温下为晶体,在加热条件下能与O2反应生成CO2、N2和H2O.现取12.6g该晶体按如图所示实验装置反应(假设各装置内反应完全).
三聚氰胺因“毒奶粉”事件成为了社会焦点.某同学为了测定三聚氰胺的分子式,查阅资料得知:三聚氰胺的相对分子质量为126,在常温下为晶体,在加热条件下能与O2反应生成CO2、N2和H2O.现取12.6g该晶体按如图所示实验装置反应(假设各装置内反应完全).查看答案和解析>>
科目: 来源: 题型:
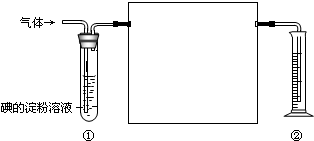 一混合气体中含有SO2、N2、O2,化学兴趣小组的同学欲测定其中SO2的体积分数,下图是他们在测定中使用的部分实验装置:
一混合气体中含有SO2、N2、O2,化学兴趣小组的同学欲测定其中SO2的体积分数,下图是他们在测定中使用的部分实验装置:查看答案和解析>>
科目: 来源: 题型:
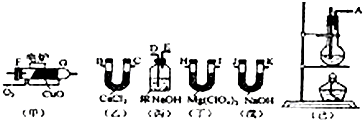
查看答案和解析>>
科目: 来源: 题型:
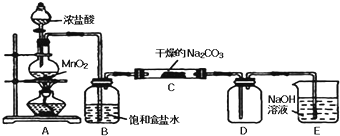
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,加入蒸馏水至固体溶解,然后各取1~2mL所得溶液分别置于甲、乙两支试管中. | 得到无色溶液 |
| 步骤2:向甲试管中加入过量的BaCl2溶液,静置 | 若溶液变浑浊,证明固体中含碳酸钠. |
| 步骤3: |
|
| 步骤4: |
查看答案和解析>>
科目: 来源: 题型:
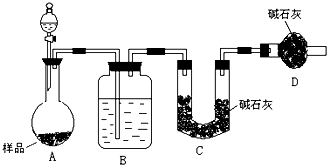 某校化学研究学习小组设计如下实验方案,测定小苏打样品中纯碱的质量分数.
某校化学研究学习小组设计如下实验方案,测定小苏打样品中纯碱的质量分数.查看答案和解析>>
科目: 来源: 题型:
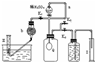 过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.
过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com