
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
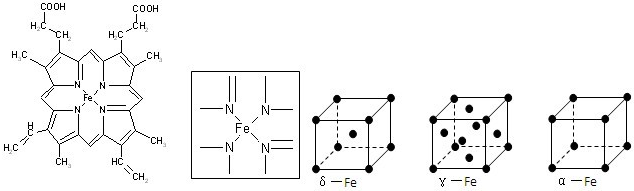
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
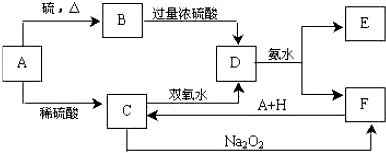
查看答案和解析>>
科目: 来源: 题型:
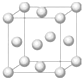 铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+1、+2 等,故能形成多种铜的化合物.
铜合金是人类使用最早的金属材料.铜在化合物中的常见化合价有+1、+2 等,故能形成多种铜的化合物.查看答案和解析>>
科目: 来源: 题型:
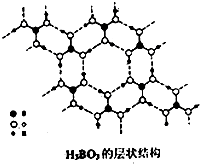 CrO3、NaBH4常用于醛、酮与醇的相互转化,由硼酸[H2BO3或B(OH)2]可以合成NaBH4.
CrO3、NaBH4常用于醛、酮与醇的相互转化,由硼酸[H2BO3或B(OH)2]可以合成NaBH4.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
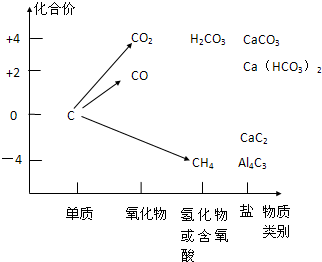 以化合价为纵坐标,以物质的类别(单质、氧化物、酸、碱、盐等)为横坐标在二维平面内所绘制的图象叫价类图.如图是某学生按山东版教材P70页的要求画出的价类图.
以化合价为纵坐标,以物质的类别(单质、氧化物、酸、碱、盐等)为横坐标在二维平面内所绘制的图象叫价类图.如图是某学生按山东版教材P70页的要求画出的价类图.查看答案和解析>>
科目: 来源: 题型:
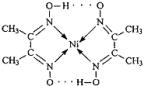 分子内的作用力有
分子内的作用力有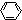 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有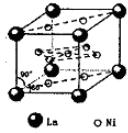
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com