
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 分类标准 | 氧化物 | 电解质 | |||
| 属于该类的物质 | ② | ⑧⑨ | ⑦ |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
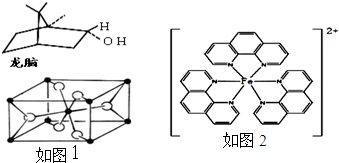 由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.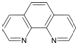 ),它能与Fe2+形成红色混合物(如图2),该配离子中Fe2+与氮原子形成配位键共有
),它能与Fe2+形成红色混合物(如图2),该配离子中Fe2+与氮原子形成配位键共有查看答案和解析>>
科目: 来源: 题型:
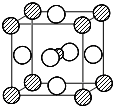 不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素.
不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素.查看答案和解析>>
科目: 来源: 题型:
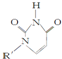 或C
或C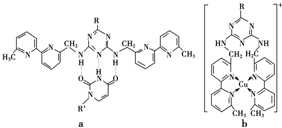
查看答案和解析>>
科目: 来源: 题型:
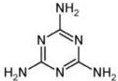 ).
).查看答案和解析>>
科目: 来源: 题型:
| A、甘油加水作护肤剂 | B、用脂肪和烧碱加热制取肥皂 | C、烹调鱼时加入少量料酒和食醋可以减少腥味、增加香味 | D、在燃料煤中添加氧化钙以减少二氧化硫的生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com