
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 实验操作 | 预期现象与结论 |
查看答案和解析>>
科目: 来源: 题型:
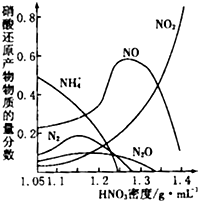 金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重.
金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁锈蚀最为严重.查看答案和解析>>
科目: 来源: 题型:
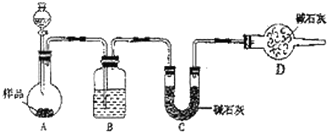
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 实验编号 | 实验记录 | |
| (3)验证鳔内含有氧气 | 将燃着的木条放入集气瓶中 | 木条能继续燃烧,证明含有氧气 |
| (4)验证鳔内含二氧化碳 | 操作方法: |
实验现象: 该反应的离子方程式是: 该实验中能否使用上述(3)实验结束后集气瓶中剩余的气体,为什么? |
| (5)分离出氮气 | 取一份装在100mL医用注射器中的鳔内气体进行分离:第一步,将气体通过 过 |
第三步实验时还可以选用 |
查看答案和解析>>
科目: 来源: 题型:
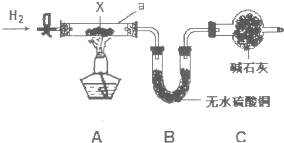
查看答案和解析>>
科目: 来源: 题型:
| 读数次数 | 质量/g | |
| 第1次 | 196.30 | |
| 第2次 | 196.15 | |
| 锥形瓶十水十试样 | 第3次 | 196.05 |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解

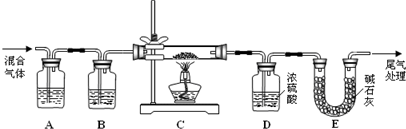
| 实验 编号 |
实验目的 | T/K | 催化剂用量/g | C/mol?l-1 | |
| KMnO4 | H2C2O4 | ||||
| ① | 为以下实验作参考 | 298 | 0.5 | 0.01 | 0.1 |
| ② | 探究KMnO4酸性溶液的浓度对该反应速率的影响 | 298 | 0.5 | 0.001 | 0.1 |
| ③ | 323 | 0.5 | 0.01 | 0.1 | |
| ④ | 探究催化剂对反应速率的影响 | 0.1 | |||
查看答案和解析>>
科目: 来源: 题型:
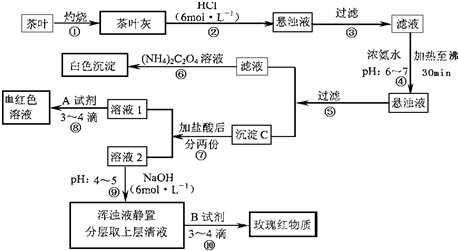
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com