
科目: 来源: 题型:阅读理解
| 分子式 | 相对分子质量 | 溶解度和溶解性 | 酸性 |
| H4C4O4 | 116 | 在水中:0.7g(25℃)、9.8g(97.5℃). 盐酸中:可溶. |
二元酸,且0.1mol/L H4C4O4的pH=2. |
| 开始沉淀时的pH | 完全沉淀时的pH |
| 7.6 | 9.6 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
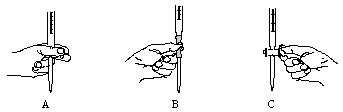
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:阅读理解
查看答案和解析>>
科目: 来源: 题型:
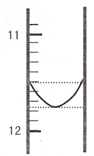 某混合碱是①Na2CO3和NaHCO3 或②Na2CO3和 NaOH.用“双指示剂法”对样品的组分和总碱量[n(Na2O)]进行测定.实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馆水和几滴酚酞,用0.0100mol?L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿--二甲基黄为指示剂进行滴定,将NaHCO3完全中和.
某混合碱是①Na2CO3和NaHCO3 或②Na2CO3和 NaOH.用“双指示剂法”对样品的组分和总碱量[n(Na2O)]进行测定.实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馆水和几滴酚酞,用0.0100mol?L-1 的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿--二甲基黄为指示剂进行滴定,将NaHCO3完全中和.| 序号 | 第一滴定终点的读数(V1/mL) | 第二滴定终点的读数(V2/mL) |
| I | ? | 26.85 |
| II | 10.02 | 25.02 |
| III | 9.98 | 24.98 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com