
科目: 来源: 题型:
| 滴定次数 | 待测液体积 (mL) |
标准盐酸体积(mL) | 滴定前读数(mL) | 滴定后读数(mL) | 第一次 | 10.00 | 0.50 | 20.40 | 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目: 来源: 题型:
| A、轮船水线以下的船壳上镶嵌有一定量的锌块 | B、镀锌的铁制品比镀锡的铁制品耐用 | C、埋在潮湿疏松土壤里的铁管比埋在干燥致密不透气的土壤里的铁管更易被腐蚀 | D、在空气中,金属银的表面生成一层黑色物质 |
查看答案和解析>>
科目: 来源: 题型:
| A、用有少量蒸馏水的锥形瓶装待测液进行中和滴定实验,对测定结果没有影响 | B、在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行3次 | C、苯酚中滴加少量稀溴水一定能出现三溴苯酚白色沉淀 | D、检验溴乙烷中的溴元素时,将溴乙烷和氢氧化钠溶液混合加热后,需加硫酸酸化 |
查看答案和解析>>
科目: 来源: 题型:
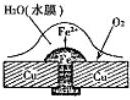 铜板上铁铆钉处的腐蚀原理如图所示,下列有关说法错误的是( )
铜板上铁铆钉处的腐蚀原理如图所示,下列有关说法错误的是( )| A、正极电极反应式为:2H++2e-=H2↑ | B、此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 | C、此过程中铁先被腐蚀 | D、此过程中电子由铜板向铁 |
查看答案和解析>>
科目: 来源: 题型:
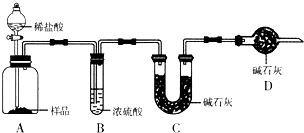 现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验.
现有甲、乙、丙三个学生,欲测定某工业纯碱样品中Na2CO3的质量分数(纯碱样品中Na2CO3的质量分数为92%~96%),分别设计如下实验方案,请你帮助他们完成实验.
|
| 分析与计算 分组 |
计算样品中碳酸钠的质量分数 | 实验结果的评价 | 实验失败的主要原因及对结果的影响 |
| 甲 | ① |
失败 | ② |
| 乙 | ③ |
成功 | ----- |
| 丙 | ④ |
成功 | ---- |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 实验方案 | 现象及结论 |
查看答案和解析>>
科目: 来源: 题型:
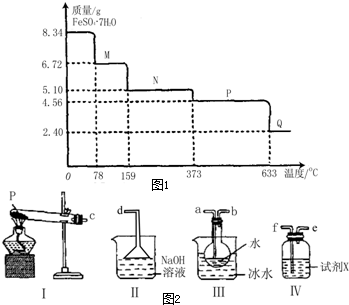 手持技术又称掌上技术,是由数据采集器、传感器和配套的软件组成的定量采集各种常见数据并能与计算机连接的实验技术系统.某研究小组利用手持技术,获得8.34g FeSO4?7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图1所示.请回答下列问题:
手持技术又称掌上技术,是由数据采集器、传感器和配套的软件组成的定量采集各种常见数据并能与计算机连接的实验技术系统.某研究小组利用手持技术,获得8.34g FeSO4?7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图1所示.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:
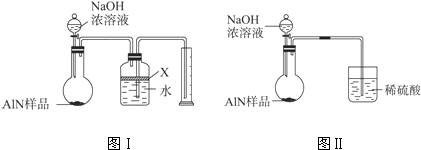
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 方案 | 操作 | 结论 |
| 甲 | 分别加入到盛水的试管中 | 放热者为浓硫酸 |
| 乙 | ||
| 丙 | ||
| 丁 |
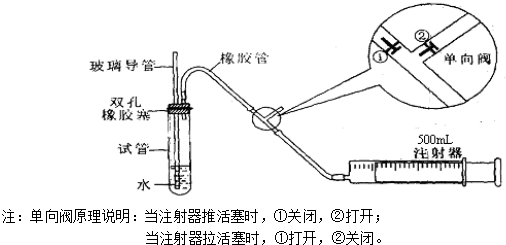
| 分组 | 第一小组 | 第二小组 |
| 抽气时间 | 20分钟 | 21分钟 |
| 抽气次数 | 100 | 130 |
| SO2含量mg/m3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com