
科目: 来源: 题型:
| 催化剂△ |
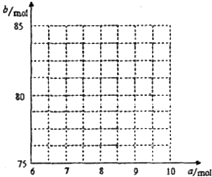
查看答案和解析>>
科目: 来源: 题型:
| A、硫酸工业制法中用水来吸收SO2 | B、石油分馏后得到的是各种纯净的烃 | C、工业上利用氯气和澄清石灰水反应来制取漂白粉 | D、氯碱工业中阳离子交换膜能阻止气体和阴离子通过 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
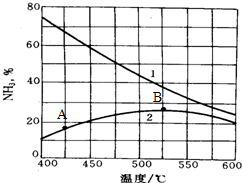
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
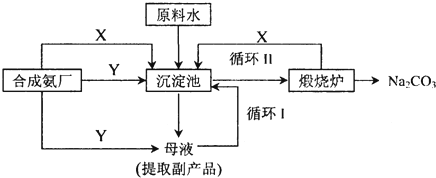
查看答案和解析>>
科目: 来源: 题型:
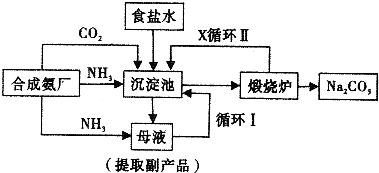
查看答案和解析>>
科目: 来源: 题型:
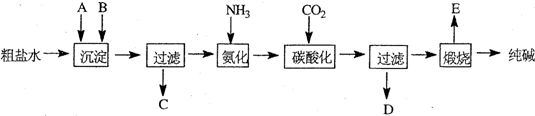
查看答案和解析>>
科目: 来源: 题型:
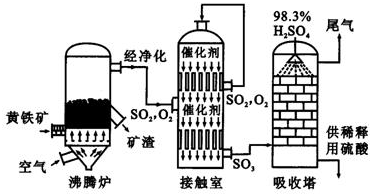
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com