
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
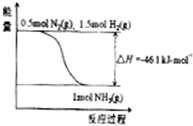 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | --- |

查看答案和解析>>
科目: 来源: 题型:
某溶液中含有Cl—和I—的物质的量浓度相同,为了氧化I—而不能使Cl—氧化,依据下列三个反应.除Cl2以外,还可选用的氧化剂是( )。
①2Fe3+十2I—=2Fe2++I2
②2Fe2++Cl2=2Fe3++2Cl—
③2MnO4—+10Cl—+16H+=2Mn2++5Cl2↑+8H2O
④Cl2+2FeCl2=2FeCl3
A.FeCl2 B.KMnO4 C.浓盐酸 D.FeCl3
查看答案和解析>>
科目: 来源: 题型:
| 加入食盐 |
| Ⅰ |
| 通入足量气体B |
| Ⅱ |
| 过滤 |
| Ⅲ |
| Ⅳ |
| A、A气体是CO2,B气体是NH3 |
| B、第Ⅲ步得到的晶体是发酵粉的主要成分 |
| C、第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒 |
| D、第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
查看答案和解析>>
科目: 来源: 题型:
| A、硫酸厂不应建在人口稠密的居民区和环保要求高的地区 | B、硫酸厂靠近原料产地比靠近硫酸消费中心更为有利 | C、硫酸厂生产过程中的污水,含有硫酸等杂质,可用石灰乳中和处理 | D、可利用硫酸厂生产过程中产生的“废热”来供热和发电 |
查看答案和解析>>
科目: 来源: 题型:
| A、硫酸生产中常采用高压条件提高SO2的转化率 | B、合成氨中采用及时分离氨气提高反应速率 | C、电解精炼铜时,溶液中c(Cu2+)基本保持不变 | D、氯碱工业电解饱和食盐水时,阳极得到氢氧化钠和氢气 |
查看答案和解析>>
科目: 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用 | 无明显现象 |
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤 | 有白色沉淀 |
| 步骤3:取少量步骤2得到的滤渣加入过量盐酸 | 滤渣不能完全溶解,说明酸雨中含有硫酸 |
| 步骤4:取适量步骤2得到的滤液, |
|
| 步骤5:往B试管中加入 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
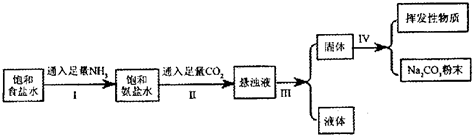
| 物质 | NH4Cl | NaHCO3 | Na2CO3 | NaCl |
| 溶解度/g | 37.2 | 9.6 | 21.5 | 36.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com