
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
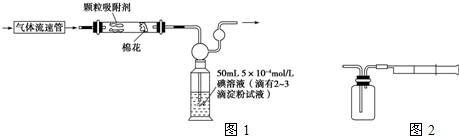
查看答案和解析>>
科目: 来源: 题型:
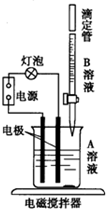 如图所示,烧杯中盛有A溶液,滴定管内盛有B溶液,B溶液不断滴下的过程中,始终开启电源,使导电线路处于通电状态,并用电磁搅拌器不断搅拌烧杯中的溶液,使之混合均匀.整个实验过程中,观察到的现象是灯泡经历“亮→暗→亮”的变化过程.
如图所示,烧杯中盛有A溶液,滴定管内盛有B溶液,B溶液不断滴下的过程中,始终开启电源,使导电线路处于通电状态,并用电磁搅拌器不断搅拌烧杯中的溶液,使之混合均匀.整个实验过程中,观察到的现象是灯泡经历“亮→暗→亮”的变化过程.| 组合 | ① | ② | ③ | ④ |
| A溶液 | NaOH溶液 | 熟石灰的悬浊液 | Ba(OH)2溶液 | NaCl溶液 |
| B溶液 | 稀盐酸 | 稀盐酸 | 稀硫酸 | AgNO3溶液 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
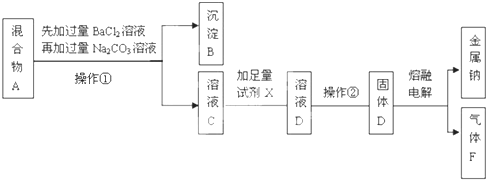
查看答案和解析>>
科目: 来源: 题型:
| c(H+) | c(OH-) |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com