
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | KW | 1×10-12 |
查看答案和解析>>
科目: 来源: 题型:
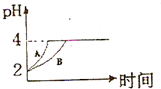 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| C(H+) |
| C(OH-) |
| C1 |
| C2 |
查看答案和解析>>
科目: 来源: 题型:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
| c(H+) |
| c(HF) |
| c(OH-) |
| c(H+) |
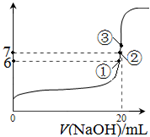
查看答案和解析>>
科目: 来源: 题型:
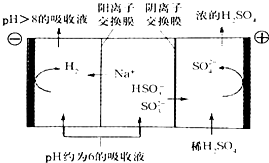 最近雾霾天气肆虐我国大部分地区.其中SO2是造成空气的污染的主要原因,利用钠碱循环法可除去SO2.
最近雾霾天气肆虐我国大部分地区.其中SO2是造成空气的污染的主要原因,利用钠碱循环法可除去SO2.| O | 2- 3 |
| O | - 3 |
| O | - 3 |
| O | 2- 3 |
N(SO
|
91:9 | 1:1 | 1:91 | ||||
| pH | 8.2 | 7.2 | 6.2 |
2- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
2- 3 |
- 3 |
查看答案和解析>>
科目: 来源: 题型:
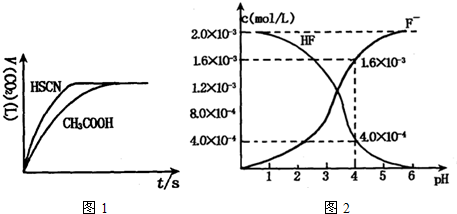
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com