
科目: 来源: 题型:
| A、在能使pH试纸变红的溶液中:Fe2+、Na+、SO42-、ClO- | B、在加入Al能放出大量H2的溶液中:NH4+、SO42-、Cl-、HCO3- | C、在加入KSCN溶液显血红色的溶液中:Fe2+、Mg2+、Cl-、SO42- | D、在pH=1的溶液中:Na+、K+、S2-、MnO4- |
查看答案和解析>>
科目: 来源: 题型:
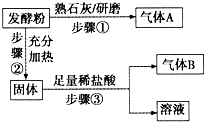 发酵粉是一种生产面制品和膨化食品的化学膨松剂,由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成.某研究性学习小组为探究不同品牌发酵粉的化学成分,进行如下实验:
发酵粉是一种生产面制品和膨化食品的化学膨松剂,由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成.某研究性学习小组为探究不同品牌发酵粉的化学成分,进行如下实验:| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| 1.取适量样品溶于稀盐酸后,将溶于分成两份 | ----- |
| 2. |
|
| 3. |
查看答案和解析>>
科目: 来源: 题型:
| H | + 4 |
| O | - 3 |
| O | 2- 3 |
| O | 2- 4 |
| 实验步骤 | 肯定不存 在的离子 |
| ①用pH试纸检验,溶液呈强酸性 | |
| ②取出部分溶液,加入少量CCl4及数滴新制的氯水,经振荡CCl4层呈紫红色 | |
| ③另取部分溶液向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中及滴加完毕后,均无沉淀产生 | |
| ④取③的部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝 | -- |
| ⑤另取③的部分碱性溶液,向其中加入Na2CO3溶液,有白色沉淀产生 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
+ 4 |
查看答案和解析>>
科目: 来源: 题型:
| 沉淀物 | 开始沉淀时的pH | 沉淀完全时的pH |
| Mg(OH)2 | 9.6 | 11.1 |
| Fe(OH)3 | 2.7 | 3.7 |
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: | |
| … |
查看答案和解析>>
科目: 来源: 题型:
 离子反应是中学化学中重要的反应类型.回答下列问题:
离子反应是中学化学中重要的反应类型.回答下列问题:| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-═H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
2- 4 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
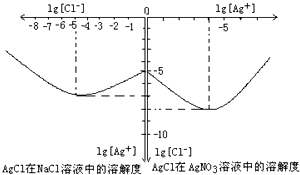 沉淀物并非绝对不溶,其在水及各种不同的溶液中溶解有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.如图是AgCl在NaCl、AgNO3 溶液中的溶解情况.
沉淀物并非绝对不溶,其在水及各种不同的溶液中溶解有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.如图是AgCl在NaCl、AgNO3 溶液中的溶解情况.查看答案和解析>>
科目: 来源: 题型:
| A、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2?Fe3++H2O | ||||
| B、FeCl3溶液与Cu的反应:Cu+Fe3+?Cu2++Fe2+ | ||||
C、NO2与水的反应:3NO2+H20?2NO
| ||||
D、NH4HCO3溶于过量的NaOH溶液中:HCO
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com