
科目: 来源: 题型:阅读理解
| 序号 | 甲 | 乙 | 丙 |
| 方案 | 用广泛pH试纸 检测溶液pH |
滴加等体积0.1mol?L-1 Ba(OH)2溶液 |
滴加等体积0.1mol?L-1 CaCl2溶液 |
| 0.01mol?L-1溶液 | NaHCO3 | Na2CO3 |
| c(CO32-)/mol?L-1 | 0.00011 | 0.0087 |
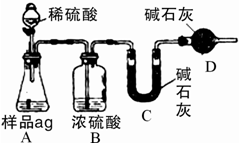
查看答案和解析>>
科目: 来源: 题型:
 氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:
氮的氧化物和SO2是常见的化工原料,但也是大气的主要污染物.综合治理其污染是化学家研究的主要内容.根据题意完成下列各题:
| ||
查看答案和解析>>
科目: 来源: 题型:
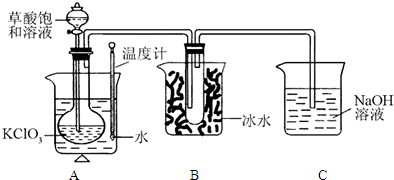
| 实验步骤 | 预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
查看答案和解析>>
科目: 来源: 题型:
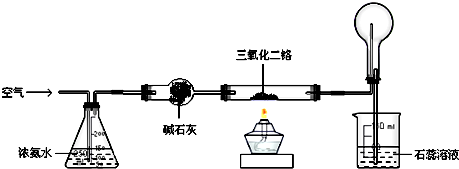
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
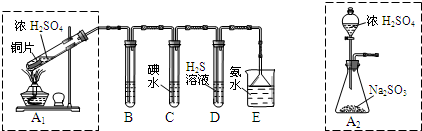
2- 3 |
2- 4 |
- 3 |
2- 3 |
- 3 |
| 实验操作 | 预期现象与结论 | ||||
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在 SO
| ||||
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 |
|||||
| 步骤3: |
查看答案和解析>>
科目: 来源: 题型:
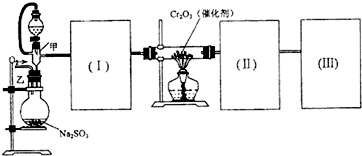
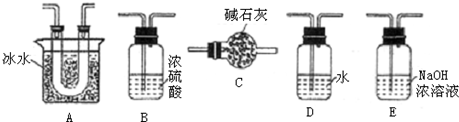
| Cl2O2 |
| 熔点(℃) | 沸点(℃) | |
| SO2 | -72.4 | -10 |
| SO3 | 16.8 | 44.3 |
查看答案和解析>>
科目: 来源: 题型:
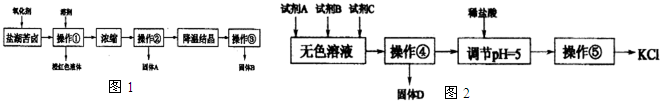
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com