
科目: 来源: 题型:
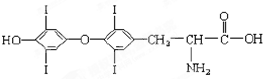 为提高人体素质,避免人体缺碘影响正常的生命活动,我国早已采取食盐加碘措施.据报道,人从食物中摄取碘后碘便在甲状腺中积存下来,通过一系列化学反应可形成甲状腺素.甲状腺素的结构如下图,回答下列问题:
为提高人体素质,避免人体缺碘影响正常的生命活动,我国早已采取食盐加碘措施.据报道,人从食物中摄取碘后碘便在甲状腺中积存下来,通过一系列化学反应可形成甲状腺素.甲状腺素的结构如下图,回答下列问题:查看答案和解析>>
科目: 来源: 题型:
| 配 料 | 氯化钠、碘酸钾 |
| 含碘量 | (20mg~40mg)/1kg |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、防潮 |
查看答案和解析>>
科目: 来源: 题型:
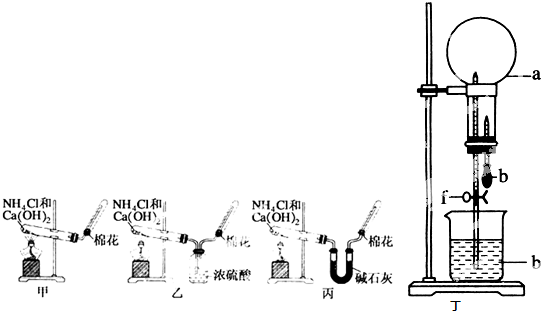
查看答案和解析>>
科目: 来源: 题型:阅读理解
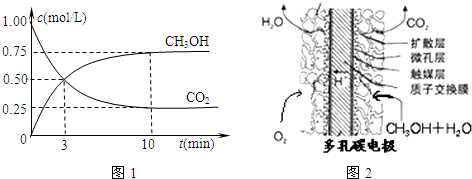
| 3 |
| 16 |
| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
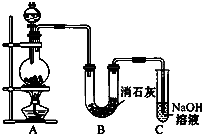 某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).请回答下列问题:
某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应).请回答下列问题:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com