
科目: 来源: 题型:
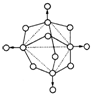 磷在空气中充分燃烧,生成X的分子结构如右图所示.图中实线表示化学键,圆圈表示原子(不考虑原子体积大小)
磷在空气中充分燃烧,生成X的分子结构如右图所示.图中实线表示化学键,圆圈表示原子(不考虑原子体积大小)查看答案和解析>>
科目: 来源: 题型:
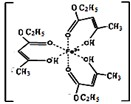 不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.
不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.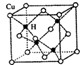 所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为
所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为查看答案和解析>>
科目: 来源: 题型:
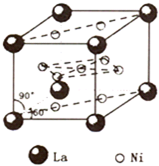 <化学--选修3:物质结构>
<化学--选修3:物质结构>139 57 |
查看答案和解析>>
科目: 来源: 题型:
| A、已知冰的熔化热为6.0kJ/mol,冰中氢键键能为20kJ/mol,假设1mol冰中有2mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | ||
B、已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,Kα=
| ||
| C、实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916kJ/mol、-3747kJ/mol和-3265kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | ||
| D、已知: Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g),△H=+489.0kJ/mol. CO(g)+
C(石墨)+O2(g)═CO2(g),△H=-393.5kJ/mol; 则4Fe(s)+3O2(g)═2Fe2O3(s),△H=-1641.0kJ/mol |
查看答案和解析>>
科目: 来源: 题型:
| A、由于水中存在氢键,所以稳定性:H2O>H2S | B、由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2 | C、分散质粒子的直径:Fe(OH) 3悬浊液>Fe(OH)3胶体>FeCl3溶液 | D、若R2-和M+的电子层结构相同,则原子半径R>M |
查看答案和解析>>
科目: 来源: 题型:
| A、分子中所有原子在同一平面内 | B、分子中不含氢原子 | C、在ABn型分子中,A元素为最高正价 | D、在ABn型分子中,A原子最外层电子均已成键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com