
科目: 来源: 题型:
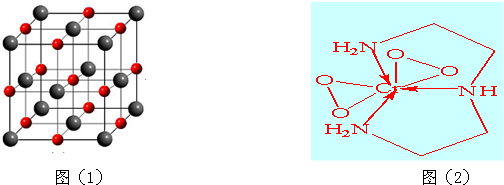
查看答案和解析>>
科目: 来源: 题型:
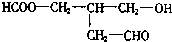 ,若使X通过化学变化失去光学活性,
,若使X通过化学变化失去光学活性,查看答案和解析>>
科目: 来源: 题型:
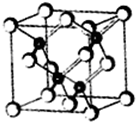 铟、镓与氮、磷、硫、砷等元素形成的化合物是制备LED晶片的主要原料,材质基本以AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.
铟、镓与氮、磷、硫、砷等元素形成的化合物是制备LED晶片的主要原料,材质基本以AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
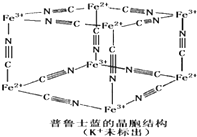 (1)铁及铁的化合物在生产、生活中有着重要的用途.
(1)铁及铁的化合物在生产、生活中有着重要的用途.查看答案和解析>>
科目: 来源: 题型:
| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
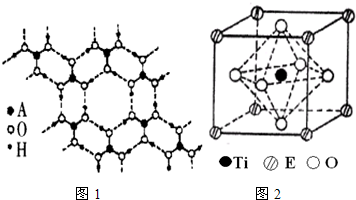
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A-B | A=B | A≡B | ||
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值(kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值(kJ/mol) | 263.6 523.3 | |||
查看答案和解析>>
科目: 来源: 题型:
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
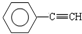 B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3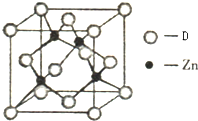
查看答案和解析>>
科目: 来源: 题型:
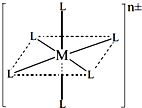
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com