
科目: 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
|
查看答案和解析>>
科目: 来源: 题型:
| A、A-离子半径小于B+离子半径 | B、B单质在C单质中燃烧生成原子个数比为1:1的化合物 | C、D的氧化物为酸性氧化物,溶于水可制得D的含氧酸 | D、D与E组成的化合物中,各原子最外层均达到8电子结构 |
查看答案和解析>>
科目: 来源: 题型:
| A、Al元素的第一电离能比Mg元素的大 | B、HF、HCl、HBr、HI的热稳定性和还原性均依次减弱 | C、同周期从左到右,原子半径和离子半径均逐渐减小 | D、酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 元素 | 相关信息 |
| W | 单质为密度最小的气体 |
| X | 元素最高正价与最低负价之和为0 |
| Y | 工业上通过分离液态空气获得其单质,该单质的某种同素异形体是保护地球地表环境的重要屏障 |
| Z | 存在质量数为23,中子数为12的核素 |
| T | 金属单质为红色,导电性好,是人体不可缺少的徽量元素,焰色反应时火焰为绿色 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 元素 | A | B | C | D | |
| 性质或结构信息 | 室温下单质呈气态,原子最外层电子数与D相同. | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软,银白色固体,导电性强,在空气中燃烧生成淡黄色固体 | E是一种气态氧化物丙,丙相对于空气的密度为3.0,溶解于水可得只含单一溶质的弱酸性溶液,该溶液在光照条件下放置酸性会增强 |
查看答案和解析>>
科目: 来源: 题型:
| 元素代号 | 相关信息 |
| W | W的基态原子核外3个能级上有电子,且每个能级上的电子数相等. |
| X | X原子核外L层电子数为奇数 |
| Y | Y是地壳中含量最多的元素 |
| Z | Z在同周期元素的简单离子中半径最小 |
查看答案和解析>>
科目: 来源: 题型:
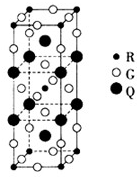 已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子.R+核外有28个电子.请回答下列问题:(答题时,A、D、E、G、L、M、R用所对应的元素符号表示)
已知A、D、E、G、L、M是核电荷数依次增大的6种短周期主族元素,其中A的原子序数与周期序数相等,D、G、L、M基态原子的最外能层均有2个未成对电子.R+核外有28个电子.请回答下列问题:(答题时,A、D、E、G、L、M、R用所对应的元素符号表示)查看答案和解析>>
科目: 来源: 题型:
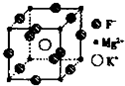 卤族元素是典型的非金属元素,包括F、Cl、Br、I等.请回答下面有关问题
卤族元素是典型的非金属元素,包括F、Cl、Br、I等.请回答下面有关问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com