
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
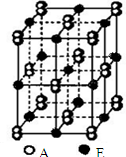 A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.A原子核外电子分处三个不同能级,且每个能级上排布的电子数相同;C原子p轨道上成对电子数等于未成对电子数;D是电负性最大的元素;E原子是元素周期表上第一个4S能级有两个电子的原子;F的核外电子数等于A、B、C、D的电子数之和.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.A原子核外电子分处三个不同能级,且每个能级上排布的电子数相同;C原子p轨道上成对电子数等于未成对电子数;D是电负性最大的元素;E原子是元素周期表上第一个4S能级有两个电子的原子;F的核外电子数等于A、B、C、D的电子数之和.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)查看答案和解析>>
科目: 来源: 题型:
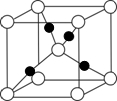
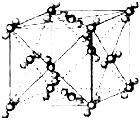 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如图所示.E的电负性在该周期中最大.镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如图所示.E的电负性在该周期中最大.镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
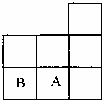 如图是元素周期表短周期的一部分,A、B两种元素可以形成共价化合物B2A2,分子中所有原子的最外层均达到8个电子的稳定结构.下列说法不正确的是( )
如图是元素周期表短周期的一部分,A、B两种元素可以形成共价化合物B2A2,分子中所有原子的最外层均达到8个电子的稳定结构.下列说法不正确的是( )| A、该化合物在熔融状态下能导电 | B、该化合物的结构式是Cl-S-S-Cl | C、该化合物形成的晶体是分子晶体 | D、该化合物分子的电子式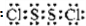 |
查看答案和解析>>
科目: 来源: 题型:
| 编号 | 元素特征信息 |
| A | 其单质是密度最小的物质. |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一. |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物. |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 元素 | D | E | F | G |
| 原子半径(nm) | 0.102 | 0.16 | 0.074 | 0.071 |
| 最高正价或最低负价 | +6 | +2 | -2 | -1 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com