
科目: 来源: 题型:
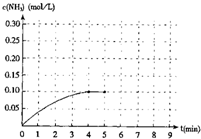 在一容积为2升的密闭容器内加入0.2mol的N2和0.6mol 的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)+Q(Q>0).反应中NH3的物质的量浓度的变化的情况如右图:
在一容积为2升的密闭容器内加入0.2mol的N2和0.6mol 的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)+Q(Q>0).反应中NH3的物质的量浓度的变化的情况如右图:查看答案和解析>>
科目: 来源: 题型:
| 时间/浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 起始 | 0.800 | 1.000 | 0.000 |
| 第2min | a | b | c |
| 第4min | 0.400 | 0.500 | |
| 第6 min | 0.700 | 0.625 | 0.120 |
查看答案和解析>>
科目: 来源: 题型:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | n(O2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
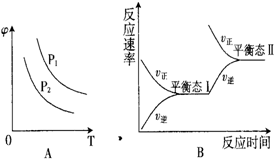 硫酸生产过程中关键阶段的反应为:
硫酸生产过程中关键阶段的反应为:| 催化剂 | 加热 |
查看答案和解析>>
科目: 来源: 题型:
| 高温 |
| 时间/min | 0 | 2 | 4 | t1 | t2 |
| n(SiCl4)/mol | |||||
| 温度/℃ | |||||
| T1 | 5.0 | 4.5 | 4.2 | n1 | n1 |
| T2 | 5.0 | 4.2 | 3.6 | n2 | n2 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
查看答案和解析>>
科目: 来源: 题型:
| 催化剂 |
| T(℃) | 0 | 50 | 100 |
| K | 0.5 | 1.05 | 2.56 |
| 催化剂 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
 乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇.
乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇.| 催化剂 |
| 催化剂 |
 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com