
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
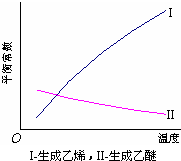
| 温度 (℃) |
乙醇转化率 (%) |
有机产物含量 (体积分数) | |
| 乙烯(%) | 乙醚(%) | ||
| 115 | 20 | 8.7 | 90.2 |
| 135 | 68 | 16.7 | 82.2 |
| 155 | 88 | 32.3 | 66.8 |
| 175 | 90 | 86.9 | 12.1 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
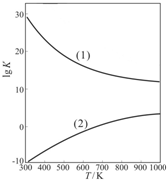
| 温度/℃ | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
| 浓度mol/L 时间/min |
c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 1 | 2 |
查看答案和解析>>
科目: 来源: 题型:
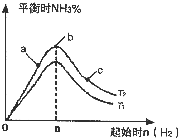 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
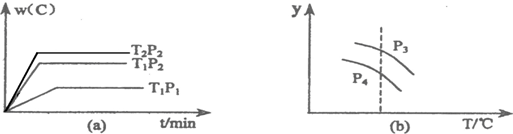
| A、P3>P4,y轴表示A的转化率 | B、P3<P4,y轴表示B的体积分数 | C、P3>P4,y轴表示混合气体的平均相对分子质量 | D、P3>P4,y轴表示混合气体的密度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com