
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
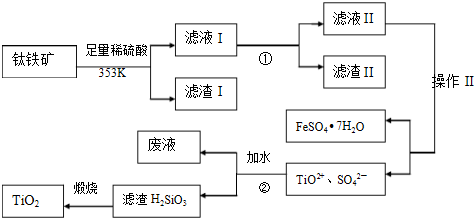
查看答案和解析>>
科目: 来源: 题型:
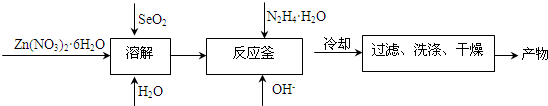
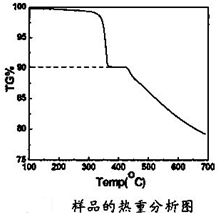 (4)将产物用X-射线粉末衍射仪(XRD)和X射线能谱仪进行物相和成分分析,发现其Zn和Se的原子个数比接近1:1,N和H的原子个数比为1:2; 产物样品经红外光谱分析可知产物中含有N-H、N-N键.结合产物样品的热重(重量-温度关系图)分析结果如图所示,推测产物的化学式可能为:
(4)将产物用X-射线粉末衍射仪(XRD)和X射线能谱仪进行物相和成分分析,发现其Zn和Se的原子个数比接近1:1,N和H的原子个数比为1:2; 产物样品经红外光谱分析可知产物中含有N-H、N-N键.结合产物样品的热重(重量-温度关系图)分析结果如图所示,推测产物的化学式可能为:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
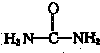 )与NO2-在酸性条件下反应生成两种无毒气体.该反应中生成16.8L(已折算为标准状况)混合气体时,消耗尿素的质量为
)与NO2-在酸性条件下反应生成两种无毒气体.该反应中生成16.8L(已折算为标准状况)混合气体时,消耗尿素的质量为查看答案和解析>>
科目: 来源: 题型:
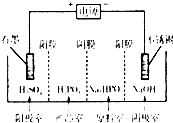 已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.
已知:Cu(OH)2是二元弱碱;亚磷酸(H3PO3)是二元弱酸,与NaOH溶液反应,生成Na2HPO3.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 室温时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
室温时,向100mL 0.1mol/L NH4HSO4溶液中滴加0.1mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com