
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| c(H+)?c(CH3COO-) | c(CH3COOH) |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 加入的HCl/mL | 1.00 | 10.00 | 28.00 | pH | 10.33 | 8.34 | 6.35 |
查看答案和解析>>
科目: 来源: 题型:
| c(CH3COO-) |
| c(CH3COOH) |
| A、①③④ | B、②③⑤⑥ |
| C、②⑤⑥ | D、①④⑥ |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
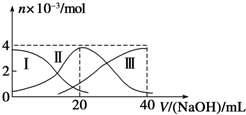 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )| A、当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) | B、等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水大 | C、NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) | D、向上述加入20mLNaOH溶液后所得溶液中再加入水的过程中,pH可能减少 |
查看答案和解析>>
科目: 来源: 题型:
| 序号 | 氢氧化钡的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 12 |
| ② | 22.00 | 18.00 | 11 |
| ③ | 22.00 | 22.00 | 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com