
科目: 来源: 题型:
- 2 |
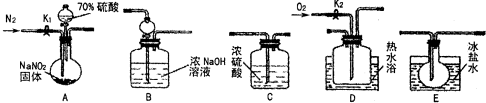
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
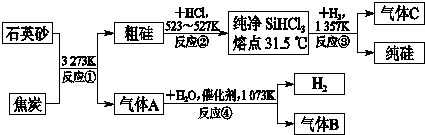
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 起始浓度(mol. L-1) | c( NH3) | c( O2) | c( NO) | c( H20) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 2 | 4 | 0 | 0 |
| 丙 | 0.5 | x | y | z |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 试管序号 | 1 | 2 | 3 | 4 | 5 |
| 通入CO2时间/min | 0 | 1 | 5 | ||
| 滴加盐酸/滴 | 0 | 3 | 6 | ||
| 溶液中颜色对比 | 无色 | 浅黄色→黄色(依次加深) | |||
| 滴加淀粉溶液后的颜色对比 | 无色 | 浅蓝色→蓝色(依次加深) | |||
| 实验步骤 | 预期现象和结论 |
| ①取一份纯净的KI固体,分成两等份; | / |
| ②一份加入到装有 一份加入到装有 ③几天后观察. |
查看答案和解析>>
科目: 来源: 题型:
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| 若溶液变蓝,假设2成立. 若溶液不变蓝,假设2不成立. | |
| … |
查看答案和解析>>
科目: 来源: 题型:
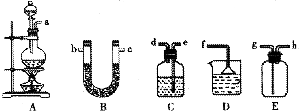
查看答案和解析>>
科目: 来源: 题型:阅读理解
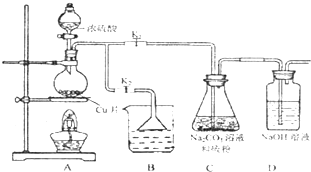 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.2- 4 |
2- 7 |
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
2- 7 |
2- 3 |
2- 6 |
查看答案和解析>>
科目: 来源: 题型:
| 实验编号 | T/K | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 | 实验目的 |
| ① | 298 | 0.1 | 0.1 | 实验①和②探究温度对该反应速率的影响;实验①、③和④探究反应物浓度对该反应速率的影响 |
| ② | 308 | |||
| ③ | 0.2 | |||
| ④ | 0.1 |
| O | 2- 4 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体于试管中,加蒸馏水溶解 | |
| 步骤2: | |
| 步骤3: |
查看答案和解析>>
科目: 来源: 题型:
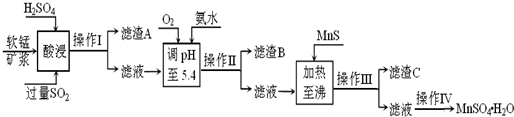
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com