
科目: 来源: 题型:
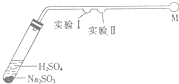 某化学兴趣小组设计了一个微型综合实验(如下图所示).用于探究.验证SO2的化学性质.图中横管凹处滴有少许检测试剂,M为一耐酸气球,请按要求填写下表空白:
某化学兴趣小组设计了一个微型综合实验(如下图所示).用于探究.验证SO2的化学性质.图中横管凹处滴有少许检测试剂,M为一耐酸气球,请按要求填写下表空白:| 序号 | 二氧化硫的性质 | 检测试剂 | 现象 | 反应的化学方程式 |
| 实验Ⅰ | 紫色石蕊试液 | |||
| 实验Ⅱ | 漂白性 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
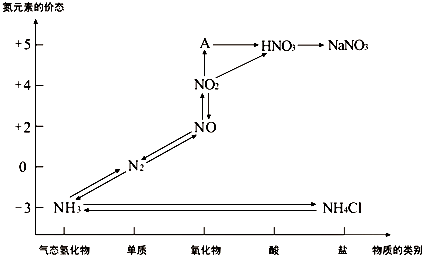
查看答案和解析>>
科目: 来源: 题型:
| ||
查看答案和解析>>
科目: 来源: 题型:
| N2 | O2 | Ar | CO2 |
| -196℃ | -183℃ | -186℃ | -78℃ |
| ||

查看答案和解析>>
科目: 来源: 题型:阅读理解
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 (1)氢气在氯气中燃烧的现象是
(1)氢气在氯气中燃烧的现象是查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
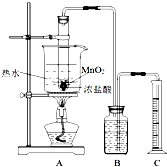 实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.
实验室常用浓盐酸与二氧化锰反应制取氯气.浓盐酸和二氧化锰反应过程中,浓盐酸的浓度不断降低,当盐酸浓度降至临界浓度时,反应停止.| 第一次实验 | 第二次实验 | 第三次实验 | |
| 盐酸的用量 | 10.0mL | 10.0mL | 10.0mL |
| 氯气的体积 | 225mL | 192mL | 223mL |
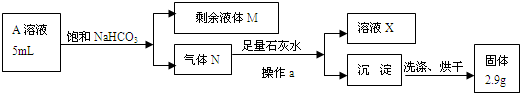
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com