
科目: 来源: 题型:
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.查看答案和解析>>
科目: 来源: 题型:
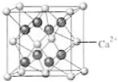 (4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是
(4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
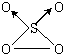
查看答案和解析>>
科目: 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子核外只有三个能级,且各能级电子数相等 |
| Y | Y的基态原子最外层电子数是其内层电子总数的3倍 |
| Z | Z的基态原子价电于排布为nsn-1 |
| W | W的单质是一种常见的红色金属,在潮湿的空气中易生成绿色的锈斑 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 氟化物 | X | Y | Z |
| 熔点/K | 1266 | 1534 | 183 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
对于反应:H- + NH3 == H2 + NH2-的正确说法是 …( )
A.属于置换反应
B.H-是还原剂
C.NH3是还原剂
D.H2既是氧化产物又是还原产物
查看答案和解析>>
科目: 来源: 题型:
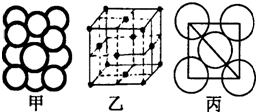 A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.
A、B、C、D、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素.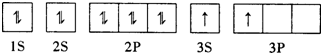
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com