
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
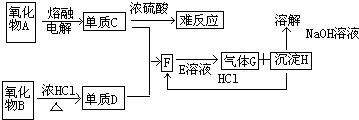
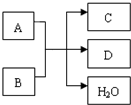 A、B、C、D是中学化学常见的物质,它们之间存在如图所示的转化关系.请按要求填空:
A、B、C、D是中学化学常见的物质,它们之间存在如图所示的转化关系.请按要求填空:查看答案和解析>>
科目: 来源: 题型:
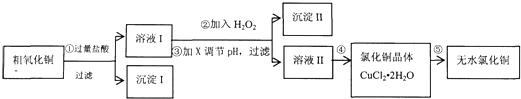
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7 | 9 |
查看答案和解析>>
科目: 来源: 题型:
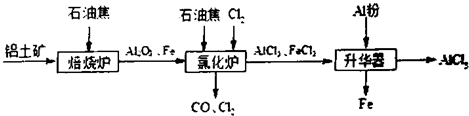
查看答案和解析>>
科目: 来源: 题型:
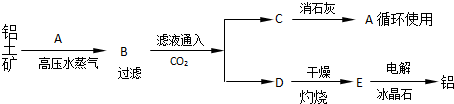
| Al2O3 | Fe2O3 | Na2O | |
| 铝土矿 | 55% | 16% | 0% |
| 赤泥 | 15% | 48% | 8% |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
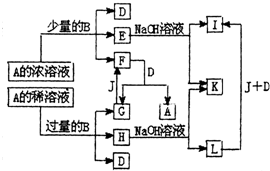 A~L所代表的各物质是中学化学里常见的物质,已知B、J是单质,A是化合物,E的溶液跟苯酚溶液混合,溶液呈紫色.A~L各物质之间相互反应转化关系如下图所示,请回答:
A~L所代表的各物质是中学化学里常见的物质,已知B、J是单质,A是化合物,E的溶液跟苯酚溶液混合,溶液呈紫色.A~L各物质之间相互反应转化关系如下图所示,请回答:查看答案和解析>>
科目: 来源: 题型:
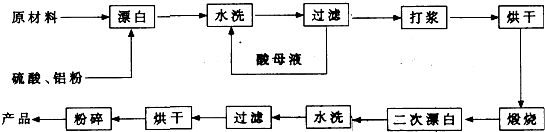
查看答案和解析>>
科目: 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com