
科目: 来源: 题型:
| 实验方案 | 实现现象 | 结论 |
| 1取一定量的合金粉末,加过量的 |
粉末部分溶解,并有气体放出. | 合金中一定含有 |
| ②取步骤①所得滤渣,加过量的 |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 |
查看答案和解析>>
科目: 来源: 题型:
| 选用试剂 | 实验现象 | |
| 第一种方法 | ||
| 第二种方法 |
| 实验步骤 | 实验现象 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
查看答案和解析>>
科目: 来源: 题型:
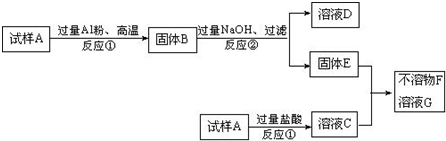
查看答案和解析>>
科目: 来源: 题型:
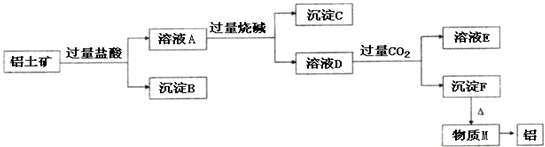
查看答案和解析>>
科目: 来源: 题型:
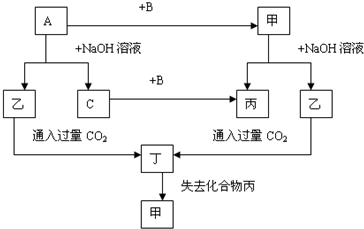
查看答案和解析>>
科目: 来源: 题型:
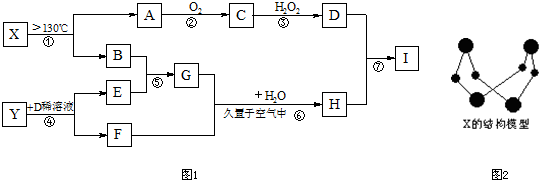
查看答案和解析>>
科目: 来源: 题型:
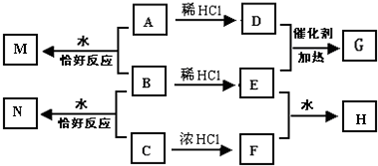 A、B、C均为钠的常见化合物,在空气中露置均易变质,且A的变质过程中伴有明显的颜色变化.已知C是一种消毒剂的有效成分,D、F为常见单质气体,E为主要的大气污染物之一,H溶液显强酸性,N溶液中的阴离子与H溶液中的相同.它们可以发生如图所示的反应.
A、B、C均为钠的常见化合物,在空气中露置均易变质,且A的变质过程中伴有明显的颜色变化.已知C是一种消毒剂的有效成分,D、F为常见单质气体,E为主要的大气污染物之一,H溶液显强酸性,N溶液中的阴离子与H溶液中的相同.它们可以发生如图所示的反应.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
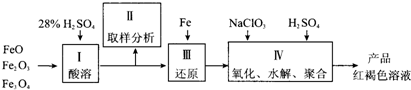
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com