
科目: 来源: 题型:

| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 实验序号 | 实验步骤 | 实验现象 | 结论 |
| ① | 用激光笔照射甲组制得的PAC溶液 | 光亮的通路 | |
| ② | 取乙组制得的样品少许加入铝试剂阿罗明拿 | 变成玫瑰红色 | |
| ③ | 取丙组样品少许,溶于适量的水制得的淡黄色透明液体中加入氟化铵 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
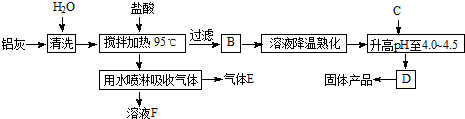
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||

查看答案和解析>>
科目: 来源: 题型:
| A、①②③ | B、③⑤ | C、④⑤ | D、③④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:
| A、Al、NaOH溶液、盐酸 | B、(NH4)2S、NaOH溶液、盐酸 | C、H2O、Na2O2、F2 | D、NaHCO3、NaHSO4溶液、盐酸 |
查看答案和解析>>
科目: 来源: 题型:
| A、焰色反应是物理变化 | B、用切割机切割金属时个别金属的原子核恰好被分成更小的微粒 | C、日常生活中我们接触到的物质从严格意义上讲都是混合物 | D、一定条件下,可制得CO2原子晶体 |
查看答案和解析>>
科目: 来源: 题型:
| A、NaAlO2溶液与HCl溶液混合后再加足量氨水 | B、AgNO3溶液与Na2CO3溶液混合后再加足量稀HCl | C、Ba(OH)2溶液与KNO3混合溶液中加足量稀H2SO4 | D、AgNO3溶液与NaOH溶液混合后再中足量氨水 |
查看答案和解析>>
科目: 来源: 题型:
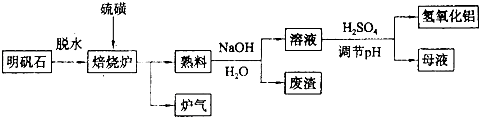
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com