
科目: 来源: 题型:
| A、放热反应一定能自发进行,吸热反应一定不能自发进行 | B、化学反应的反应热不仅与体系的始态和终态有关,也与反应的途径有关 | C、催化剂不仅能加快反应速率,也能增大反应物的转化率 | D、升高温度,能提高活化分子百分数,不能提高反应所需的活化能 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
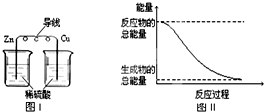
| A、化学反应中能量变化的主要原因是化学键的断裂与生成 | B、铝热反应中,反应物的总能量比生成物的总能量低 | C、图I所示的装置能将化学能转变为电能 | D、图II所示的反应为吸热反应 |
查看答案和解析>>
科目: 来源: 题型:
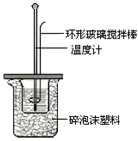 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.3 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.0 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目: 来源: 题型:
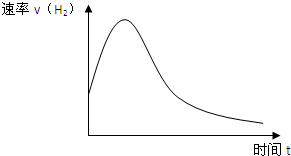 如图表示Zn投入一定浓度一定体积的稀H2SO4溶液中后,反应时间与生成H2的体积的图象.(纵坐标为H2的生成速率)
如图表示Zn投入一定浓度一定体积的稀H2SO4溶液中后,反应时间与生成H2的体积的图象.(纵坐标为H2的生成速率)查看答案和解析>>
科目: 来源: 题型:
| 改变的反应条件 | 降低温度 | 增大O2的浓度 | 使用V205作催化剂 | 减小SO2的浓度 |
| 反应速率的变化 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
查看答案和解析>>
科目: 来源: 题型:阅读理解
| ||
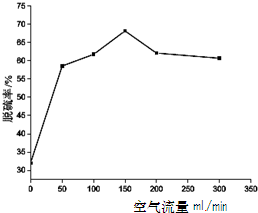
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 时间(min) 浓度(mol/L) |
0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com