
科目: 来源: 题型:
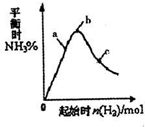 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.
工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.| 1 | 2 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.
甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.| 1 | 2 |
查看答案和解析>>
科目: 来源: 题型:

| t/min | 0 | 5 | 10 |
| AO/mol?L-1 | 1.00 | 0.65 | 0.50 |
| H2/mol?L-1 | 2.00 | 1.00 | |
| AH3OH/mol?L-1 | 0.00 | 0.35 | 0.50 |
查看答案和解析>>
科目: 来源: 题型:
| 1 | 2 |
查看答案和解析>>
科目: 来源: 题型:
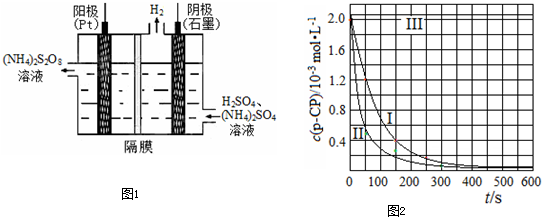
| 实验 编号 |
T/K | pH | c/10-3mol?L-1 | |
| H2O2 | Fe2+ | |||
| Ⅰ | 298 | 3 | 6.0 | 0.30 |
| Ⅱ | 313 | 3 | 6.0 | 0.30 |
| Ⅲ | 298 | 10 | 6.0 | 0.30 |
查看答案和解析>>
科目: 来源: 题型:
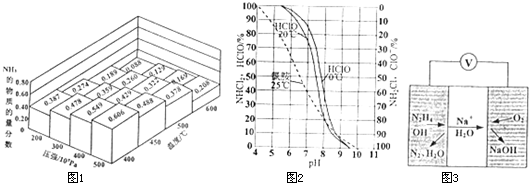
 如图是一种以某燃料电池为电源,对氯化钠溶液进行电解的装置.该燃料电池的电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2),在熔融状态下能传导O2-.
如图是一种以某燃料电池为电源,对氯化钠溶液进行电解的装置.该燃料电池的电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2),在熔融状态下能传导O2-.查看答案和解析>>
科目: 来源: 题型:
| O | 2- 3 |
| O | - 3 |
n(S
|
91:9 | 1:1 | 9:91 | ||||
| pH | 8.2 | 7.2 | 6.2 |
| O | 2- 3 |
| O | - 3 |
| O | - 3 |
| O | 2- 3 |
| O | 2- 3 |
| O | - 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com