
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 2CO(g)+O2(g)?2CO2(g)反应过程的能量变化如图所示.已知1mol CO (g)氧化为1mol CO2 (g)的△H=-283kJ/mol.请回答下列问题:
2CO(g)+O2(g)?2CO2(g)反应过程的能量变化如图所示.已知1mol CO (g)氧化为1mol CO2 (g)的△H=-283kJ/mol.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:
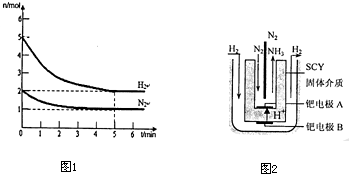
查看答案和解析>>
科目: 来源: 题型:
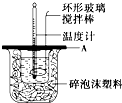 分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.| 实验 序号 |
起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目: 来源: 题型:
| c(Na+) | ||
c(C
|
| 20 |
| 9 |
| C1 |
| C2 |
查看答案和解析>>
科目: 来源: 题型:
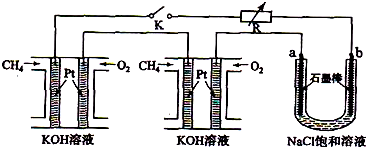
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
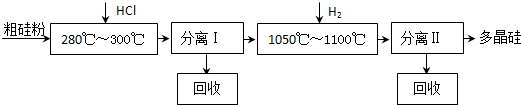
查看答案和解析>>
科目: 来源: 题型:
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
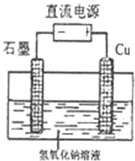
| ||
| 光照 |
| Cu2O |
| 序号 | t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| C/mol-1 | |||||||
| 温度/℃ | |||||||
| ① | T1 | 0.500 | 0.492 | 0.486 | 0.482 | 0.480 | 0.480 |
| ② | T1 | 0.500 | 0.488 | 0.484 | 0.480 | 0.480 | 0.480 |
| ③ | T2 | 0.500 | 0.450 | 0.450 | 0.450 | 0.450 | 0.450 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com