
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
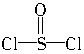 )中形成的,电池总反应为:8Li+3SOCl2=6LiCl+Li2SO3+2S。下列叙述中正确的是( )。
)中形成的,电池总反应为:8Li+3SOCl2=6LiCl+Li2SO3+2S。下列叙述中正确的是( )。查看答案和解析>>
科目: 来源: 题型:
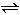 CH3COOH+OH-而使溶液呈碱性。
CH3COOH+OH-而使溶液呈碱性。查看答案和解析>>
科目: 来源: 题型:
 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )。
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )。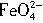 +4H2O
+4H2O查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com