
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
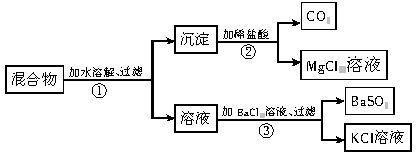
查看答案和解析>>
科目: 来源: 题型:
 CH3COO-+H+,对于该平衡,下列叙述中正确的是()。
CH3COO-+H+,对于该平衡,下列叙述中正确的是()。查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
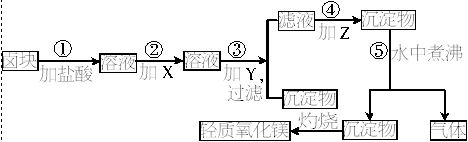
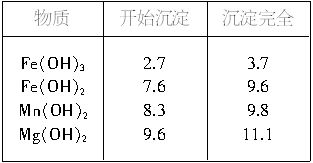

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。
(1)取一镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内的稀盐酸中。足量镁条与一定量盐酸反应生成H2时的量与反应时间的关系曲线如图2所示。
①请你在图3方框中画出上述反应的反应速率与时间的定性关系曲线;
②已知镁与盐酸反应是放热反应,从该反应事实中你得到的结论是____________________________。
(2)分别量取10.00mL1mol/L盐酸和醋酸溶液加入如图1所示装置的锥形瓶中,同时将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全结束后,恢复到室温。观察到反应过程中产生H2的快慢不同,但量筒中水的体积均为VmL。你认为造成上述反应速率不等的原因是_____________________。
(3)用铝分别与H+浓度相同的稀盐酸和稀硫酸反应时,实验现象明显不同:铝与稀盐酸反应,产生气泡较快;铝与稀硫酸反应,产生气泡较慢。从反应本质看,两者的实验现象应该相同。在不考虑该实验条件下温度变化、操作和药品纯度的情况下,请你对上述实验现象提出假设,并设计一简单的实验来验证你的假设。
①你的假设_______________________________;
②实验操作和现象是_______________________。
查看答案和解析>>
科目: 来源: 题型:
温度相同、浓度均为0.2mol?L-1的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤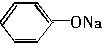 、⑥CH3COONa溶液,它们的pH由小到大的排列顺序是()。
、⑥CH3COONa溶液,它们的pH由小到大的排列顺序是()。
A.③①④②⑥⑤ B.①③⑥④②⑤
C.③②①⑥④⑤ D.⑤⑥②④①③
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com