
科目: 来源: 题型:
已知H2O2分子的结构如右图所示,H2O2分子不是直线形分子,而是两个H原子犹如在半展开的书的两面纸上,书页夹角为94°,而两个键与键的夹角均为97°,试回答:
(1)写出H2O2分子的结构式:________________。
(2)写出H2O2分子内的键型:________________。
(3)估计它难溶于CS2,简要说明原因:_________
___________________________________。
(4)指出氧元素的化合价,简要说明原因:______
___________________________________。

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
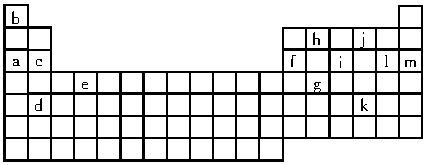
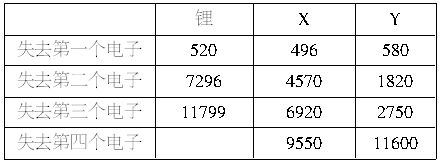
科目: 来源: 题型:
现代研究证明:电子在核外空间所处的位置及其运动速度不能同时准确地确定。为了描绘核外电子的运动情况,在量子力学中采用了统计的方法,即对一个电子多次的行为或许多电子的一次行为进行总的研究。右图是对氢原子核外一个电子千百万次的运动状态统计而得到的,人们形象地称之为“电子云”(呈三维对称)。试回答下列问题:

(1)从图中千百万次运动状态的统计结果,你能得出什么结论:___________________。
(2)离核越近,电子的能量越_______;离核越远,电子的能量越________。请说明你是怎样得出这一结论的:__________________。
查看答案和解析>>
科目: 来源: 题型:
某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定实验如下:
①需配制0.1 mol?L-1的盐酸和0.1mol?L-1的氢氧化钠溶液;
②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20.00mL蒸馏水;
③以酚酞为指示剂,用0.1mol?L-1的氢氧化钠溶液滴定,达到滴定终点时消耗氢氧化钠溶液VmL;
④加入25.00mL0.1mol?L-1的盐酸溶液。
需滴定两次,所需NaOH溶液的体积取平均值,请回答下列问题:
(1)写出实验过程的步骤:___________________(写编号顺序)。
(2)下图所示的仪器中,配制0.1mol?L-1盐酸溶液和0.1mol?L-1氢氧化钠溶液时肯定不需要的仪器是_________(填序号),配制上述溶液还需要的玻璃仪器是_____________________(填仪器名称)。
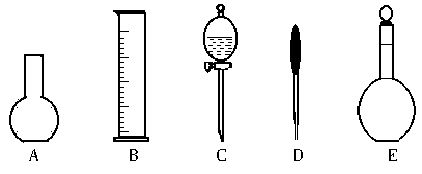
D.250mL、250mL
(4)写出有关反应的化学方程式:____________。
(5)胃药中含碳酸钙的质量是_______________。
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com