
科目: 来源: 题型:
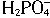 D.
D.
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
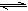
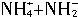 ,两种离子的平衡浓度均为1.0×10-15mol?L-1。以下有关-50℃时液氨的离子积的叙述中正确的是( )。
,两种离子的平衡浓度均为1.0×10-15mol?L-1。以下有关-50℃时液氨的离子积的叙述中正确的是( )。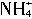 浓度增大,离子积的数值也随之增大
浓度增大,离子积的数值也随之增大查看答案和解析>>
科目: 来源: 题型:
 CO2(g)+H2(g),达到平衡时,K=
CO2(g)+H2(g),达到平衡时,K=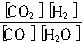 ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。查看答案和解析>>
科目: 来源: 题型:
 pC(g)+qD(g) ΔH=Q,开始时容器内充入A和B或C和D,如下图分别表示反应达到平衡后,改变压强和温度对反应速率和化学平衡的影响,则下列关系中正确的是()。
pC(g)+qD(g) ΔH=Q,开始时容器内充入A和B或C和D,如下图分别表示反应达到平衡后,改变压强和温度对反应速率和化学平衡的影响,则下列关系中正确的是()。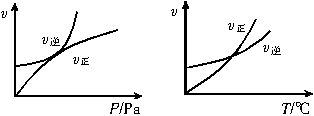
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 2NH3)容器中充入一定量的NH3(已知起始时,N2、H2的物质的量之比为1∶3)。
2NH3)容器中充入一定量的NH3(已知起始时,N2、H2的物质的量之比为1∶3)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com