
科目: 来源: 题型:
 2HI(g) ΔH<0。
2HI(g) ΔH<0。
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
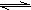 xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol?L-1。请填空:
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol?L-1。请填空:查看答案和解析>>
科目: 来源: 题型:
 3C(g)+D(g),达到平衡时,C的浓度为wmol?L-1。若维持容器的容积和温度不变,按下列情况配比为起始浓度,达到平衡后C的浓度仍为wmol?L-1的是()。
3C(g)+D(g),达到平衡时,C的浓度为wmol?L-1。若维持容器的容积和温度不变,按下列情况配比为起始浓度,达到平衡后C的浓度仍为wmol?L-1的是()。查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 C来说,v=kcm(A)cn(B),其中k为常数。
C来说,v=kcm(A)cn(B),其中k为常数。 C,在25℃时,将A、B溶液按不同浓度混合,得到下列实验数据(见下表):
C,在25℃时,将A、B溶液按不同浓度混合,得到下列实验数据(见下表):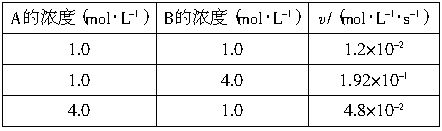
查看答案和解析>>
科目: 来源: 题型:
 2C(g),在某温度时,反应的平衡常数是64。如果反应开始时,A(g)与B(g)的浓度都是0.05mol?L-1,计算A在此反应条件下的平衡转化率。
2C(g),在某温度时,反应的平衡常数是64。如果反应开始时,A(g)与B(g)的浓度都是0.05mol?L-1,计算A在此反应条件下的平衡转化率。查看答案和解析>>
科目: 来源: 题型:
 C(g)。
C(g)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com