
科目: 来源: 题型:
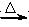 W + Y
W + Y查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
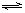 H2(g)+CO2(g)在某一温度达到平衡时,平衡常数Kc=1.0。已知c0(CO)=2mol?L-1、c0(H2O)=3mol?L-1,求该温度下达到平衡时CO转化为CO2的转化率。
H2(g)+CO2(g)在某一温度达到平衡时,平衡常数Kc=1.0。已知c0(CO)=2mol?L-1、c0(H2O)=3mol?L-1,求该温度下达到平衡时CO转化为CO2的转化率。查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
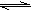 3Z(g),已知加入2molX和3molY达到平衡后,生成amolZ。
3Z(g),已知加入2molX和3molY达到平衡后,生成amolZ。查看答案和解析>>
科目: 来源: 题型:
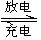 Fe(OH)2+2Ni(OH)2
Fe(OH)2+2Ni(OH)2查看答案和解析>>
科目: 来源: 题型:
在一次实验中,某同学把铝片分别放入稀盐酸、稀硫酸中,发现铝片与稀盐酸反应的现象非常明显,而与稀硫酸几乎不反应。这和课本中“铝能跟稀盐酸或稀硫酸反应生成氢气”的说法不一致。为了排除因试剂变质等因素造成的影响,该同学在老师的指导下重新进行了下列实验,验证是否存在上述现象。
【药品】3.0mol?L-1盐酸、1.5mol?L-1硫酸、3.0mol?L-1硫酸、相同大小的铝片(纯度>99.5%)
【实验过程】往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol?L-1盐酸、1.5mol?L-1硫酸、3.0mol?L-1硫酸。观察反应进行到1、2、5、15、20min时铝与酸反应的情况。其结果如下:
通过上述实验可知,无论是用1.5mol?L-1H2SO4还是3.0mol?L-1H2SO4均无明显现象,
而3.0mol?L-1盐酸与铝片反应的现象却十分明显。
【提出问题】
(1)写出铝与酸反应的离子方程式:_____。
(2)反应1~15min内,铝与盐酸反应的反应速率逐渐加快,其原因是___________________。
(3)根据以上探究,你能对“铝与稀盐酸和稀硫酸反应差异的原因”作出哪些假设或猜想(列出两种即可)?
①___________________。
②___________________。
(4)为了验证上述假设,你设计的实验方案是___________________。
查看答案和解析>>
科目: 来源: 题型:
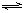 2SO3(g)在某温度达到平衡时,各物质的浓度是[SO2]=0.1mol?L-1、[O2]=0.05mol?L-1、[SO3]=0.9mol?L-1。如果体系温度保持不变,而将体积减少到原来的一半,试通过计算说明平衡移动的方向。
2SO3(g)在某温度达到平衡时,各物质的浓度是[SO2]=0.1mol?L-1、[O2]=0.05mol?L-1、[SO3]=0.9mol?L-1。如果体系温度保持不变,而将体积减少到原来的一半,试通过计算说明平衡移动的方向。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com